
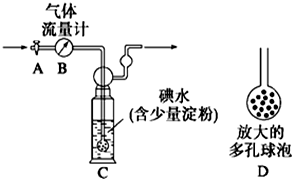
分析 方案利用图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.原理为:SO2+I2+2H2O=H2SO4+2HI,当洗气瓶C中溶液蓝色消失时,立即关闭活塞A,依据化学方程式定量关系确定二氧化硫的物质的量,进而定尾气中二氧化硫的含量,
(1)连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使反应充分;
(2)C中为二氧化硫与单质碘反应生成硫酸和氢碘酸;
(3)没有及时关闭活塞A,则通过流量计的气体中的二氧化硫不能全部被吸收.
解答 解:(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
故答案为:增大气体与溶液的接触面积,有利于SO2与碘水反应;
(2)C中为二氧化硫与单质碘反应生成硫酸和氢碘酸,硫酸与氢碘酸为强酸,所以其反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+;
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
(3)没有及时关闭活塞A,则通过流量计的气体中的二氧化硫不能全部被吸收,所以测得的二氧化硫的量偏小,则二氧化硫的含量偏低;
故答案为:偏低.
点评 本题考查了硫酸工厂排放尾气中二氧化硫的含量的测定,涉及方案评价、离子方程式的书写、误差分析,侧重于基础知识的考查,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池中电子由正极流向负极 | |
| B. | 原电池负极和电解池阳极均发生氧化反应 | |
| C. | 在电解池中有氢气生成的电极可能是阳极 | |
| D. | 电镀时,镀层金属做阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该有机物的分子式为C11H15O3 | |
| B. | 该有机物不能发生取代反应 | |
| C. | 1 mol该物质与足量的钠反应可以生成1 mol氢气 | |
| D. | 1 mol该有机物可以与1 mol碳酸钠发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的摩尔质量是2克 | |
| B. | 20克氖气所含分子数为0.5NA(NA为阿伏加德罗常数) | |
| C. | 将20克NaOH固体溶于1L水所得溶液的物质的量浓度为0.5mol/L | |
| D. | 在相同温度和压强下,等质量的SO2和SO3所含硫原子个数比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH浓溶液,加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 溶液X中有NH4+ |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成红色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 常温下,将铜放入浓硫酸中 | 无明显变化 | 铜在冷的浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com