
| A. | 钢是铁合金,钢的含碳量低于生铁,性能优于生铁 | |
| B. | 金属具有的物理通性是延展性、导热性、银白色光泽、导电性 | |
| C. | 符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质 | |
| D. | 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点 |
分析 A.钢含Fe、C等,钢中的含C量低,性能高;
B.大多数金属为银白色光泽;
C.Al可表示元素、单质及1个原子;
D.合金的熔点比各成分的低.
解答 解:A.钢含Fe、C等,为铁的合金,钢的含碳量低于生铁,性能优于生铁,故A正确;
B.大多数金属为银白色光泽,某些金属不具有,金属具有的物理通性是延展性、导热性、导电性,故B错误;
C.Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质,故C正确;
D.合金的熔点比各成分的低,则焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点,故D正确;
故选B.
点评 本题考查金属的性质,为高频考点,把握金属的性质及合金的性质为解答的关键,侧重分析与应用能力的考查,注意元素符号的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度为0.1mol/L | B. | 浓度为1mol/L | C. | 含NaOH 4g | D. | 含NaOH 0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
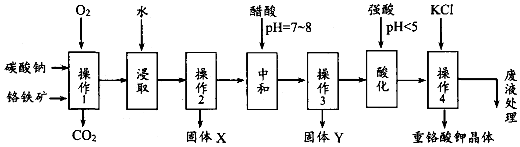
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
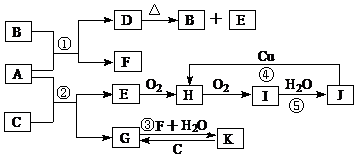
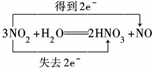 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
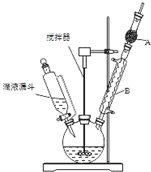 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com