
| A. | 乙烷的沸点低于甲烷,密度大于甲烷 | |
| B. | 相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃 | |
| C. | 苯酚在任何温度下,均微溶于水 | |
| D. | 酯在碱性条件下的水解反应均为皂化反应 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
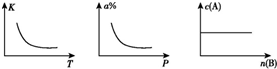
| A. | m+n<p,△H>0 A、B、C均为气体 | B. | m<p△H<0 A、C均为气体 | ||
| C. | n>p,△H>0 B、C均为气体 | D. | m>p,△H<0 A、C均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E | |
| B. | 若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同 | |
| D. | 若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LHCl溶于水后溶液中含有NA个HCl分子 | |
| B. | 常温常压下,33.6LCl2中含有1.5NA个Cl2分子 | |
| C. | 1.8g的NH4+离子中含有NA个电子 | |
| D. | 将0.1mol氯化铝溶于1L水中,所得溶液含有0.1NAAl3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$发烟硝酸 | |
| B. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$→_{熔融}^{电解}$Al | |
| C. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{蔗糖}$Cu2O | |
| D. | SiO2$→_{高温}^{Na_{2}CO_{3}}$Na2SiO3$\stackrel{盐酸}{→}$硅酸凝胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 向KI溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com