
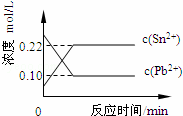
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 |
|
| A. | 往平衡体系中加入金属铅后,c(Pb2+)增大 |
|
| B. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
|
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
|
| D. | 25℃时,该反应的平衡常数K=2.2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
如下图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是( )

| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸溶液 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
糖尿病是由于人体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动都易导致患糖尿病。
(1)血糖是指血液中的葡萄糖,下列说法正确的是________(填序号)。
A.葡萄糖属于碳水化合物,分子式可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O分子
B.可用新制的氢氧化铜悬浊液来检测糖尿病病人尿液中的葡萄糖含量
C.葡萄糖可用于制镜工业
D.淀粉、纤维素水解的最终产物都是葡萄糖
(2)木糖醇是一种甜味剂,糖尿病病人食用后不会使血糖升高。木糖醇与葡萄糖________(填“互为”或“不互为”)同分异构体。请预测木糖醇的一种化学性质:________。
(3)糖尿病病人不可饮酒,酒精在肝脏内可被转化成有机物A。已知A的相对分子质量为60;将A溶于水,滴入石蕊试液,发现溶液变红。则A的结构简式为_____________________________________________ ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程都与热量变化有关,其中表述不正确的是( )
|
| A. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO(g)+ |
|
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为 |
|
| C. | 铝热反应是放热反应,但需要足够的热量才能使反应发生 |
|
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中C%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间。下图(A)为温度一定时,压强与反应速率的关系曲线;下图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是

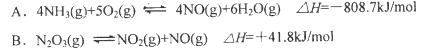
查看答案和解析>>
科目:高中化学 来源: 题型:
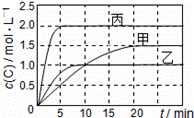
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)⇌2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
下列说法正确的是( )
|
| A. | 10min内甲容器中反应的平均速率v(A)=0.025mol/(L•min) |
|
| B. | 由图可知:T1<T2,且该反应为吸热反应 |
|
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡移动 |
|
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.浓硝酸中加入过量铁粉并加热:Fe+3NO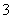 +6H+=Fe3++3NO2↑+3H2O
+6H+=Fe3++3NO2↑+3H2O
B.Ca(HCO3)2溶液与过量NaOH溶液反应 HCO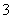 +OH-+Ca2+===CaCO3↓+H2O
+OH-+Ca2+===CaCO3↓+H2O
C.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+===Fe3++3H2O
D.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:
Ba2++2OH-+NH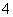 +HCO
+HCO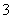 ===BaCO3↓+NH3·H2O+H2O
===BaCO3↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+ O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
②若温度为T1时,反应进行到状态D时,V正_______V逆(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产中有重要作用。
① 右图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:(△H用含字母Q1、Q2的代数式表示) 。

②在AlCl3溶液中滴加氨水,反应的离子方程式为: 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是 全品教学网, 用后离不了!,产生该现象的原因是(用离子方程式表示): 。
全品教学网, 用后离不了!(已知25℃时Ksp[AgCl] =1.0×10-10 mol2•L-2,Ksp[AgI] =1.5×10-16mol2•L-2 )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com