
����Ŀ����Ӧ2HI(g)![]() H2(g)+I2(g) ��H=Q����4�ֲ�ͬ�����½��У���֪��ʼʱI2��H2�����ʵ���Ϊ0����Ӧ��HI��Ũ�ȣ�mol/L)�淴Ӧʱ�䣨min)�ı仯������±���ʾ��
H2(g)+I2(g) ��H=Q����4�ֲ�ͬ�����½��У���֪��ʼʱI2��H2�����ʵ���Ϊ0����Ӧ��HI��Ũ�ȣ�mol/L)�淴Ӧʱ�䣨min)�ı仯������±���ʾ��
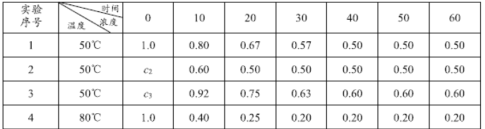
(1)ʵ��1�У���Ӧ��010 min��ƽ������v(HI)Ϊ_______mol��L-1��min-1����ϸ�����ϱ����ݿ���֪Q ______0 (����>����<������=��)��
(2)ʵ��2�У�HI�ij�ʼŨ��c2 Ϊ_____mol��L-1.��ƽ��ǰʵ��1��ƽ����Ӧ����Ϊv1��ƽ��ǰʵ��3��ƽ����Ӧ����Ϊv3����v1 ____v3 (����>����<������=��)���� c3Ϊ________mol��L-1��
���𰸡�0.02 > 1.0��1 < 1.2
��������
��1���ɱ����֪��010 min��![]() ����ʵ��1��ʵ��4�Աȿ�֪���¶����ߣ�HI��ת�������ߣ���ƽ�������ƶ��������¶ȣ�ƽ�������ȷ�Ӧ�ƶ���������Ϊ���ȷ�Ӧ��
����ʵ��1��ʵ��4�Աȿ�֪���¶����ߣ�HI��ת�������ߣ���ƽ�������ƶ��������¶ȣ�ƽ�������ȷ�Ӧ�ƶ���������Ϊ���ȷ�Ӧ��
�ʴ�Ϊ��0.02��>��
��2������ʵ��1��2���ݷ������¶���ͬ����ƽ���HI�����ʵ���Ũ����ͬ����H2��I2��ʼŨ��Ϊ0����������ʵ����HI����ʼŨ����ͬΪ1.0molL-1 ��ʵ��1��3�Ƚϣ��¶���ͬ��10min-20minʱ��ʵ��3��Ũ�ȼ�����������ʵ��1�ģ�����ʵ��3�ķ�Ӧ���ʴ���ʵ��1�ģ���v3>v1��ʵ��2��ʵ��3���¶���ͬ���÷�ӦΪ����������Ӧ��ʵ��2ƽ��ʱ��(HI)=50%��ʵ��3��ʵ��2��Ϊ��Чƽ�⣬���ʵ��3����(HI)=50%����c3= ![]() =1.2mol/L��
=1.2mol/L��
�ʴ�Ϊ��1.0��1��<��1.2��


 ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�鰴����ʵ������̽�������е⺬���IJⶨ�͵����ȡ��
ʵ��һ���⺬���IJⶨ
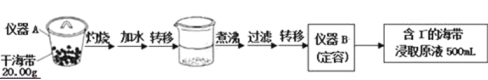
ȡ0.0100mol/L��AgNO3����Һ�ζ�100.00mL������ȡԭҺ���õ��Ƶζ����ⶨ��ĺ�������õĵ綯�ƣ�E����ӳ��Һ��c��I���� �仯�������ִ��������Ƴ��ζ����������߱仯��ͼ��ʾ��

ʵ����������ȡ
��ȡ������ȡԭҺ���ס�������ʵ�鷽����ͼ��ʾ��
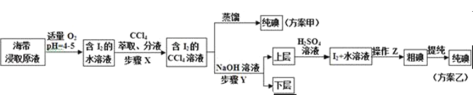
��֪��3I2+6NaOH��5NaI+NaIO3+3H2O
��ش�
��1��ʵ��һ�е��������ƣ�����A______������B______��ʵ����в���Z������______��
��2�����ݱ������߿�֪���˴εζ��յ�ʱ��ȥAgNO3��Һ�����Ϊ______ml������ú����е�İٷֺ���Ϊ______��
��3������X�У���ȡ���Һ©���ڹ۲쵽��������______��
��4�������йز���Y��˵������ȷ����______
A��Ӧ����NaOH��Һ��Ũ�Ⱥ���� B������ת�������ӽ���ˮ��
C����Ҫ�dz�ȥ������ȡԭҺ�е��л����� D��NaOH��Һ�������Ҵ�����
�������У��ϲ�Һ������ᷢ����Ӧ�����ӷ���ʽ��______��
��5�������������������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������п��һ�ֶ���Ե����������ϣ�ijС���Դ�����п��������ͭ�������Ϊԭ��ģ�ҵ������������п���������£�

��֪����������������pH��Χ���±���ʾ��
Zn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ����pH | 5.4 | 7.0 | 2.3 | 4.7 |
��ȫ����pH | 8.0 | 9.0 | 4.1 | 6.7 |
����������
��1������I������25%ϡ�������98%Ũ���ᣨ�ܶ�Ϊ1.84g/mL�����ƣ���������������������ձ��⣬����Ҫ_______��ѡ���ţ�
A��������ƽ B����Ͳ C������ƿ D����ͷ�ι�
��2������II��ͨ������KMnO4����������ZnO����pH�����Գ�ȥ�������ʣ���������Ƿ���ȫ��ʵ�������_________������pH�����˷�Χ��_________��
��3������III�м���Zn�۵������ǣ���________���ڽ�һ��������ҺpH��
��4������IV��ʹ����NH4HCO3��Һ�ܴٽ�Zn2+ת��Ϊ���������¶Ȳ��˹��ߣ���ԭ�������________��
��5������V��_______�����������ƣ��н��У���֪��ʽ̼��п�Ļ�ѧʽΪZn5��OH��6��CO3��2����д��������Ӧ�Ļ�ѧ����ʽ��________���ж��ѷֽ���ȫ�IJ�����________��
��6�������·����ⶨ���û�������п�Ĵ��ȣ�
��ȡ1.000g��������п����15.00mL 1.000mol/L������Һ��ȫ�ܽ�
����Ũ��Ϊ0.500mol/L�ı�����������Һ�ζ�ʣ�����ᣬ�����յ�ʱ��������������Һ12.00mL��
�������ʲ����뷴Ӧ�������û�������п�Ĵ���Ϊ_______�����ڵζ�ʱ��ʵ�ʲ����й�����Σ�1mL��ҺΪ25�Σ����εζ���������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ӧ��Ӧ�����ӷ���ʽ��ȷ���ǣ�������
A.����������Һ��ͨ�������������ClO��+H2O+SO2��HClO+HSO3��
B.��̼��������Һ�м����������������Һ2HCO3��+Ca2++2OH����CaCO3��+2H2O+CO32-
C.����������Һ��������Һ��Ӧ�õ�������ҺBa2++OH��+H++SO42����BaSO4��+H2O
D.50 mL 1mol/L��NaOH��Һ��ͨ��0.03mol H2S��5OH��+3H2S��HS��+2S2��+5H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����ͭ�ڼ�����650��ʱ��ʼ�ֽ���������ͭ�����壮ij�С��ͨ��ʵ�飬̽����ͬ�¶�������������ɣ�ʵ��װ�����£�
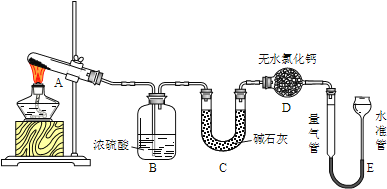
ÿ��ʵ�����ⶨB��C�����ĸı��E���ռ�������������ʵ���������£�E�������������������״������
ʵ����� | �¶� | ��ȡCuSO4����/g | B��������/g | C��������/g | E���ռ�������/mL |
�� | T1 | 0.640 | 0.320 | 0 | 0 |
�� | T2 | 0.640 | 0 | 0.256 | V2 |
�� | T3 | 0.640 | 0.160 | Y3 | 22.4 |
�� | T4 | 0.640 | X4 | 0.192 | 33.6 |
��1��ʵ�������A�е�������______��D����ˮ�Ȼ��Ƶ�������_______��
��2���ڲ���E���������ʱ��Ӧע����_______��Ȼ�����ˮ���������ܵ�Һ����ƽ����ˮ����Һ����������ܣ�����������______������ƫ��������ƫС����������������
��3��ʵ�����B�����յ�������_____��ʵ�����E���ռ�����������______��
��4���Ʋ�ʵ�����CuSO4�ֽⷴӦ����ʽΪ��_______��
��5�����ݱ������ݷ�����ʵ�����������C���ӵ�����Y3=_______g��
��6�����ƽ���ƶ�ԭ�����Ƚ�T3��T4�¶ȵĸߵͲ�˵������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ�������ʵ��ܽ�ȼ��±��������£���500g����ر�����Һ��Ͷ��2gʳ�Σ������ƶ���ȷ����(����)
���� | �ܽ��( g/100gˮ) |
�Ȼ��� | 36 |
����� | 32 |
������ | 87 |
�Ȼ��� | 37 |
A.ʳ�β��ܽ�
B.ʳ���ܽ⣬��������
C.ʳ���ܽ⣬����2 g����ؾ���
D.ʳ���ܽ⣬����2 g�Ȼ��ؾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�Ⱦ�Ϊ0.1mol/L�����и�����Һ������Һ(��)�μӵ���Һ(��)�У������Һ(I)�ĵ��������仯������ͼ�仯���Ƶ���(����)
A | B | C | D | |
��Һ(��) | ���� | ���� | �������� | ��ˮ |
��Һ(��) | �������� | �������� | ��ˮ | ������ |

A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ۺ�ij���������xFeOyFe2O3����ĩ������ȼ����ֳ����ȷݣ�һ���ڸ�����ǡ����ȫ��Ӧ�������������ᷴӦ����һ��ֱ�ӷ����������ռ���Һ�г�ַ�Ӧ��ǰ��������������ɵ�������������5��7����x��yΪ��������
A.1��1B.1��2C.5��7D.7��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹����(�ṹ��ʽ��ͼ)������ˬ����ζ�����ԼΪ���ǵ�200���������й�˵������ȷ����

A. ����ʽΪ��C14H18N2O5
B. ��˹�����������3�ֹ�����
C. ��˹������һ�������¼������ᷴӦ��������Ӧ
D. ��˹�����ˮ������������ְ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com