

 图1 图2
图1 图2| A.过量铁粉 | B.氯化钡溶液 | C.银粉 | D.碳酸氢钠溶液 |
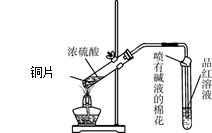
 CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。因此还有一定量的硫酸剩余。②A、若有硫酸剩余,则加入Fe粉时会发生反应:Fe+H2SO4=FeSO4+H2↑。冒气泡。正确。B.无论是否有硫酸剩余,在溶液中都含有SO42-,加入氯化钡溶液时发生反应:Ba2++ SO42-=BaSO4↓。产生白色沉淀。错误。C. 在金属活动性顺序表中Ag在H的后面,不能把酸中的H置换出来。错误。D.酸性H2SO4 >H2CO3,所以加入碳酸氢钠溶液时发生反应H2SO4+ 2NaHCO3=Na2SO4+2H2O+2CO2↑。冒气泡。正确。故正确选项为A 、D。
CuSO4+SO2↑+2H2O随着反应的进行,浓硫酸会变成稀硫酸,而稀硫酸不与铜反应。因此还有一定量的硫酸剩余。②A、若有硫酸剩余,则加入Fe粉时会发生反应:Fe+H2SO4=FeSO4+H2↑。冒气泡。正确。B.无论是否有硫酸剩余,在溶液中都含有SO42-,加入氯化钡溶液时发生反应:Ba2++ SO42-=BaSO4↓。产生白色沉淀。错误。C. 在金属活动性顺序表中Ag在H的后面,不能把酸中的H置换出来。错误。D.酸性H2SO4 >H2CO3,所以加入碳酸氢钠溶液时发生反应H2SO4+ 2NaHCO3=Na2SO4+2H2O+2CO2↑。冒气泡。正确。故正确选项为A 、D。

科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
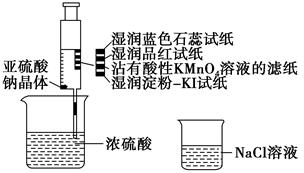
| A.蓝色石蕊试纸先变红后退色 |
| B.品红试纸、沾有酸性KMnO4溶液的滤纸均退色,证明SO2具有漂白性 |
| C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2 |
| D.NaCl溶液可用于除去实验中多余的SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
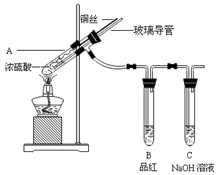
| A.含1 mol H2SO4的浓硫酸中有n(H+)=2n(SO42-)=2 mol |
| B.含1 mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子为2 mol |
| C.配制2.0 mol·L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) |
| D.用铜电极电解2.0 mol·L-1的硫酸,阴阳两极生成气体的体积之比为2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性KMnO4溶液中通入SO2气体后溶液褪色 |
| B.滴入酚酞的NaOH溶液中通入SO2气体红色消失 |
| C.品红溶液中通入SO2气体红色消失 |
| D.溴水中通入SO2气体后溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2能使品红溶液褪色是因为SO2具有氧化性,所以它也能使酸碱指示剂褪色 |
| B.硫化氢中硫显最低价态-2价,因此只具有还原性 |
| C.浓硫酸使木棒或棉花变黑,体现了浓硫酸的吸水性 |
| D.BaSO4可作“钡餐”进行X射线检查 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨溶于水的喷泉实验,说明氨气极易溶于水 |
| B.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化 |
| C.浓硝酸久置显黄色,说明浓硝酸具有不稳定性 |
| D.向胆矾中加入浓硫酸后出现白色的现象,说明浓H2SO4具有吸水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用作“钡餐”的物质主要成分是硫酸钡 |
| B.采用催化设施,将汽车尾气中CO和NO转化为无害气体 |
| C.常温下,可以用铁制容器来盛装冷的浓硫酸 |
| D.SO2具有氧化性,可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.湿润的蓝色石蕊试纸先变红后褪色 |
| B.左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com