
【题目】Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
元素 | 相关信息 |
Q | Q的单质是实验室常用的惰性电极材料 |
R | R原子基态时2p原子轨道上有3个未成对电子 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
X | X是第三周期电负性最大的元素 |
Y | 元素Y位于周期表第10列 |
Z | Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是
(2)下列叙述正确的是 a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2 . QT分子中σ键π键的个数比为;QT2分子中,Q原子采取杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为 , 且为(填“极性”或“非极性”)分子.
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为;晶体中每个镁原子周围距离相等且最近的Y原子有个. 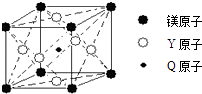
【答案】
(1)1s22s22p63s23p63d104s1
(2)d
(3)1:2; sp
(4)直线形;非极性
(5)MgNi3C;12
【解析】解:Q的单质是实验室常用的惰性电极材料,则Q为碳元素;R原子基态时2p原子轨道上有3个未成对电子,原子核外电子排布式为1s22s22p3,故R为N元素;负二价的元素T和氢的化合物在通常情况下是一种液体,其中T的质量分数为88.9%,负二价的元素T和氢的化合物为H2X,令T的相对分子质量为a,则 ![]() =88.9%,解得a=16,所以T为O元素;X是第三周期电负性最大的元素,则X为Cl;元素Y位于周期表第10列,则Y为Ni;Z存在质量数为65,中子数为36的核素,则质子数为65﹣36=29,故Z为Cu.(1)Z为Cu元素的原子基态时的电子排布式是:1s22s22p63s23p63d104s1,
=88.9%,解得a=16,所以T为O元素;X是第三周期电负性最大的元素,则X为Cl;元素Y位于周期表第10列,则Y为Ni;Z存在质量数为65,中子数为36的核素,则质子数为65﹣36=29,故Z为Cu.(1)Z为Cu元素的原子基态时的电子排布式是:1s22s22p63s23p63d104s1,
所以答案是:1s22s22p63s23p63d104s1;(2)a.非金属性Q(碳)<R(N),故R的最简单气态氢化物比Q的气体氢化物稳定,故a错误;
b.碳酸为弱酸,而硝酸为强酸,故b错误;
c.氨气分子之间形成氢键,熔点在同族元素形成的氢化物中高于其它分子晶体的,故c错误;
d.同周期自左而右电负性增大,氮元素原子2p能级为半满稳定状态,能量较低,N元素的第一电离能、电负性均比碳的大,故d正确,
故选:d;(3)Q和T可形成两种常见化合物,分别表示为CO与CO2.CO分子结构简式为C≡O,分子中σ键π键的个数比为1:2,CO2分子为直线型结构,C原子采取sp杂化,
所以答案是:1:2;sp;(4)有关理论认为N2O与CO2具有相似的结构,故的空间构型为直线形,且为非极性分子,
所以答案是:直线形;非极性;(5)含有C、Ni和镁三种元素的某种晶体具有超导性,根据晶胞结构可知,晶胞中Mg原子数目为8× ![]() =1,C原子数目为1,Ni原子数目为6×
=1,C原子数目为1,Ni原子数目为6× ![]() =3,则该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离最近的Ni原子处于以Mg为顶点的面心上,补全晶胞可知,Mg原子为12个面共用,故晶体中每个镁原子周围距离最近的Ni原子有12个,
=3,则该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离最近的Ni原子处于以Mg为顶点的面心上,补全晶胞可知,Mg原子为12个面共用,故晶体中每个镁原子周围距离最近的Ni原子有12个,
所以答案是:MgNi3C;12.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,盛有催化剂的体积一定的密闭容器中,通入一定量的SO3气体,发生分解反应2SO32SO2+O2 , 并达到平衡状态,测得SO3的分解率为75%.下列说法正确的是( )
A.平衡后的压强为起始压强的1.25倍
B.平衡时混合气体的平均相对分子质量为64
C.混合气体的密度自始至终保持不变
D.取和SO3等质量的SO2和O2的混合气体,从逆反应开始并达到平衡,在相同条件下各物质的浓度与原来的平衡浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去;优氯净中氯元素的化合价为;无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另一固体.请写出无水亚硫酸钠受热分解的反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,△H>0且△S>0的是( )
A.CaCO3(s)═CaO(s)+CO2(g)
B.NH3(g)+HCl(g)═NH4Cl(s)
C.4Al(s)+3O2(g)═2Al2O3(s)
D.H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如图1: 
(1)写出“碱浸”反应的离子方程式;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42﹣ . 当BaMoO4开始沉淀时,SO42﹣的去除率是;[已知:碱浸液中c(MoO42﹣)=0.40molL﹣1 , c(SO42﹣)=0.04molL﹣1 , Ksp(BaSO4)=1.1×10﹣10、Ksp(BaMoO4)=4.0×10﹣8 , 加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是;
(4)如图2是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4﹣Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2 . NaNO2的作用是;
③若缓释剂钼酸钠﹣月桂酸肌氨酸总浓度为300mgL﹣1 , 则缓蚀效果最好时钼酸钠的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中甲池是以甲醇为原料,KOH为电解质的高效燃料电池,电化学过程的如图.下列说法中不正确的是( ) 
A.甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
B.若乙池中为足量AgNO3溶液,则阳极的电极反应为4OH﹣﹣4e﹣=2H2O+O2↑
C.若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH,则电解过程中转移的电子数为0.2NA
D.常温常压下,1g CH3OH燃料生成CO2和液态H2O时放热22.68kJ,表示该反应的热化学方程式为CH3OH(l)+1.5O2(g)═CO2(g)+2H2O(l)△H=﹣725.80kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.向NaHCO3溶液中滴加澄清石灰水,不会产生沉淀
B.等质量NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2在同温同压下体积相同
C.向Na2CO3溶液中缓慢通入等物质的量的HCl,生成的CO2与原Na2CO3的物质的量之比为1:2
D.向Na2CO3饱和溶液中通入CO2 , 有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:
(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____(填序号).
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为 .
(3)反应②的化学方程式为 .
(4)反应③发生时观察到的现象是 .
(5)反应④中的CO2不宜换成HCl,原因是 .
(6)请分别举出固体A和B的一种用途、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com