



科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下单斜硫比正交硫稳定 |
B.单斜硫转变为正交硫的能量变化可用下图表示 |
| C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ |
| D.反应①中生成1 L SO2 (g)放出297.16kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g)+196.6 kJ,下列说法正确的是
2SO3(g)+196.6 kJ,下列说法正确的是| A.1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 |
| B.将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 |
C.S(g)+O2(g) SO2(g)+Q,Q值小于297.16 kJ SO2(g)+Q,Q值小于297.16 kJ |
| D.当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
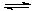 H++ SO42-
H++ SO42- 的废水会发生如下反应:
的废水会发生如下反应: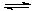 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+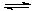 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
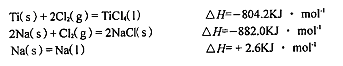
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
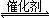 2CO2(g)+S(l) △H
2CO2(g)+S(l) △H
 HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K="8.0" × 106 L?mol-1,计算时SO2、H2SO3的浓度忽略不计)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3OH(l)+ 3/2O2(g)=CO2(g)+ 2H2O(l);△H="+725.8" kJ·mol-1 |
| B.2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(l);△H="-1452" kJ·mol-1 |
| C.2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(l);△H="-725.8" kJ·mol-1 |
| D.2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(l);△H="+1452" kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com