
【题目】下列反应的离子方程式书写正确的是( )
A.Fe溶于足量稀HNO3:3Fe+8H++2![]() =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
B.NaHCO3溶液与NaOH溶液反应:![]() +OH-=CO2↑+H2O
+OH-=CO2↑+H2O
C.向NaAlO2溶液中加入过量的稀HCl:![]() +H++H2O=Al(OH)3↓
+H++H2O=Al(OH)3↓
D.氨水和醋酸溶液混合:NH3H2O+CH3COOH=NH4++CH3COO-+H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72LCH4;②3.01x1023个HCl;③13.6gH2S;④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( )
A.体积:④<①<②<③
B.密度:①<④<③<②
C.质量:④<①<③<②
D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
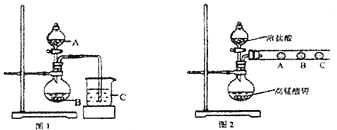
(1)甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是 ;但该装置存在缺陷,请指出 。
(2)乙同学设计了如图2装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。乙同学可能观察到的现象
A. ;B. ;C. 。
从环保角度考虑,该装置有明显不足,请指出提出改进建议 。
Ⅱ、另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 |
|
|
2 |
|
|
请根据以上信息简要解释溶解阳极泥不用王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程。
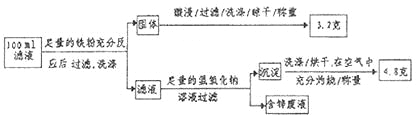
则![]() 滤液中
滤液中![]() 的浓度为
的浓度为 ![]() ,
,![]() 的浓度为
的浓度为 ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室分别用以下4个装置完成实验。下列有关装置、试剂和解释都正确的是
A.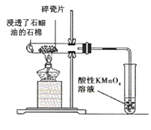 中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
B. 所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
C.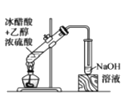 为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
D. 为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以重晶石(BaSO4为主,含有钙等杂质)为原料,可按如下工艺生产碳酸钡:
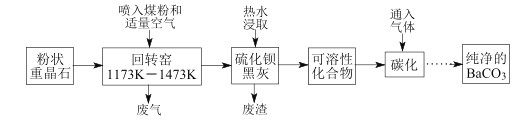
温度为1173K~1473K时回转窑中发生的主要反应:C+O2![]() CO2,C+CO2
CO2,C+CO2![]() 2CO;BaSO4+4C
2CO;BaSO4+4C![]() BaS+4CO↑,BaSO4+2C
BaS+4CO↑,BaSO4+2C![]() BaS+2CO2↑。
BaS+2CO2↑。
(1)煤粉的主要作用是______________。
(2)若回转窑中通过量空气,则BaCO3产率________(填“降低”、“升高”、“不变”)。
(3)用 90~95℃的热水浸取BaS转化为可溶性化合物时无气体生成,此过程反应的化学方程式__________________。
(4)在回转窑产生的废气,其中________可以在碳化过程得到重新利用;硫化钡黑灰热水浸取,保温后热过滤除去的残渣也可在其他工业生产中再利用,如废渣中的 CaSO4可作 ____________(写一种即可)。
(5)为了得到纯净的BaCO3,省略的操作是_____________________。
(6)已知反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
BaCO3(s)+SO42-(aq),某同学利用该反应在实验室模拟BaSO4转化为BaCO3的过程:若每次加入1 L 2 mol/L的Na2CO3溶液,至少需要____次,可以将0.3 mol BaSO4完全转化为BaCO3。[Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A. 该合金中铜与镁的物质的量之比是2:1
B. NO2和N2O4的混合气体中,NO2的体积分数是80%
C. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。


(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=0的某X溶液中,除H+外,还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量X溶液进行如下一系列实验:

下列有关判断不正确的是( )
A. 生成气体A的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B. 生成沉淀H的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. 溶液X中一定没有的离子仅为:CO32-、Ba2+
D. 溶液X中一定含有的离子是:H+、Fe2+、SO42-、NH4+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com