
【题目】将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C+H2O![]() CO+H2。 C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO+H2。 C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1①
H2(g)+ ![]() O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
CO(g)+ ![]() O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
(1)请你根据以上反应,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:__________________。
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量________(填“多”或“少”)。
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”乙同学根据盖斯定律作出了下列循环图:

请你写出△H1、△H2、△H3、△H4之间存在的关系式:________________________________。
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”)同学,另一同学出现错误观点的原因是_________。
【答案】 C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5 kJ·mol-1 多 △H1=△H2+△H3+△H4 乙 甲同学忽视了反应C(s)+H2O(g)=CO(g)+H2(g)为吸热反应
【解析】(1)①C(石墨,s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,②CO(g)+ ![]() O2(g)=CO2(g)△H=-283.0 kJ/mol,③H2(g)+
O2(g)=CO2(g)△H=-283.0 kJ/mol,③H2(g)+ ![]() O2(g)=H2O(g)△H=-242.0kJ/mol,根据盖斯定律,①-②-③得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol,故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol;
O2(g)=H2O(g)△H=-242.0kJ/mol,根据盖斯定律,①-②-③得:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol,故答案为:C(石墨,s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol;
(2)①C(s)+O2(g)=CO2(g)△H1=-393.5kJmol-1;②H2(g)+ ![]() O2(g)=H2O(g)△H2=-242.0kJmol-1;③CO(g)+
O2(g)=H2O(g)△H2=-242.0kJmol-1;③CO(g)+ ![]() O2(g)=CO2(g)△H3=-283.0kJmol-1;比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量多;化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;△H1、△H2、△H3、△H4之间存在的关系式为:△H1=△H2+△H3+△H4;依据盖斯定律可知,将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同,乙正确;煤转化为水煤气要吸收热量,煤炭燃烧时加少量水,结合盖斯定律可知,煤炭燃烧放出相同的热量;故答案为:多;△H1=△H2+△H3+△H4;乙;甲同学忽视了反应C(s)+H2O(g)=CO(g)+H2(g)为吸热反应。
O2(g)=CO2(g)△H3=-283.0kJmol-1;比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量多;化学反应不管是一步完成还是分几步完成,其反应热是相同的;也就是说,化学反应的反应热只与反应的始态和终态有关,与反应途径无关.即如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同;△H1、△H2、△H3、△H4之间存在的关系式为:△H1=△H2+△H3+△H4;依据盖斯定律可知,将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同,乙正确;煤转化为水煤气要吸收热量,煤炭燃烧时加少量水,结合盖斯定律可知,煤炭燃烧放出相同的热量;故答案为:多;△H1=△H2+△H3+△H4;乙;甲同学忽视了反应C(s)+H2O(g)=CO(g)+H2(g)为吸热反应。


科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的只有( )
A. 碱性:KOH>NaOH B. 元素的金属性:Mg>Al
C. 酸性:HNO3>H2CO3 D. 相对原子质量:Ar>K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检查汽油中含有不饱和链烃的方法是 ( )
A.加入溴水振荡后,观察溴水层是否褪色
B.加入溴水振荡后,观察汽油层是否变为红棕色
C.加入酸性高锰酸钾溶液振荡后,观察是否褪色
D.通入氢气,观察是否发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在101 kPa时,32.0 g N2H4(液态)在氧气中完全燃烧生成氮气和H2O,放出热量624 kJ(25 ℃时),N2H4完全燃烧的热化学方程式是__________________。
(2)肼空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼空气燃料电池放电时:
正极的电极反应式是______________________________________;
负极的电极反应式是______________________________________。
(3)如图是一个电解过程示意图。

①锌片上发生的电极反应式是_______________________________。
②假设使用肼空气燃料电池作为本过程中的电源,铜片的质量变化为128 g,则肼空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. 混合溶液的pH=7
B. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C. a=b
D. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是
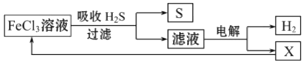
A. 滤液pH<7的主要原因是阳离子水解所致
B. 电解开始的一段时间,阳极区有黄绿色气体逸出
C. 可用点燃充分燃烧的方法消除H2S污染
D. 取少量电解液滴加K3[Fe(CN)6]溶液,若没有沉淀则应该停止电解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K、100 kPa时,已知:①2H2O(g)===O2(g)+2H2(g)ΔH1
②Cl2(g)+H2(g)===2HCl(g)ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性后,继续滴加时:
2H++SO42-+Ba2++2OH- ![]() BaSO4↓+2H2O
BaSO4↓+2H2O
B. NaHCO3 溶液中加少量Ba(OH)2溶液: HCO3—+Ba2++OH—![]() BaCO3↓+H2O
BaCO3↓+H2O
C. 向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全:
2Al3++3 SO42-+3Ba2++6OH![]() 2A1(OH)3↓+3BaSO4↓
2A1(OH)3↓+3BaSO4↓
D. 向Ca(ClO)2溶液中通入过量的SO2:
Ca2++2ClO-+2SO2+2H2O![]() CaSO4↓+4H++2Cl-+SO42—
CaSO4↓+4H++2Cl-+SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量是科学研究的重要方法。向2 mL H2O2溶液中滴入2滴1 mol/LCuSO4溶液,下列条件下分解速率最快的是
选项 | A | B | C | D |
H2O2溶液的物质的量浓度(mol·L1) | 1 | 1 | 4 | 4 |
反应的温度(℃) | 5 | 40 | 5 | 40 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com