
 电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(
电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(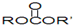 )作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )
)作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )| A、放电时Li+移动方向与曲线①一致 |
| B、电解质溶液不能用醋酸溶液代替碳酸酯类 |
| C、充电时阴极反应式:Li++e-═Li |
| D、充电时b电极接电源的正极 |


科目:高中化学 来源: 题型:
| A、1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出QkJ的热量 |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
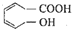 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )| A、该醇烯酸的分子式为C7H8O3 |
| B、既可以通过加聚反应形成高分子,也可以通过缩聚反应形成高分子 |
| C、不能使酸性高锰酸钾溶液褪色 |
| D、分子内能形成六元环的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、①②③④⑤ |
| C、①④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体分子的数目和分子本身的大小 |
| B、气体分子的质量和分子本身的大小 |
| C、气体分子的数目和分子间的平均距离 |
| D、气体分子本身的大小和分子间的平均距离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氨汽化时要放出大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氧化铝是一种电解质,可用于制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C、Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
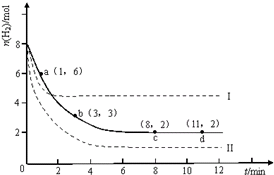 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com