

图6-10
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将_________,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸。造成倒吸的操作上的原因是__________________。
(3)浓硫酸的作用是:①__________________;②__________________。
(4)饱和Na2CO3溶液的作用是__________________。
(5)实验生成的乙酸乙酯,其密度比水_________ (填“大”或“小”),有_________气味。
(6)若实验中温度过高,使反应温度达到
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
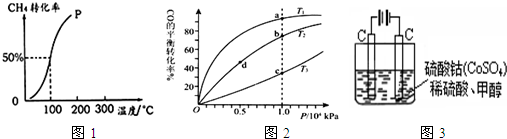
 (2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
(2012?枣庄二模)物质在水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值(25℃):
| ||
| ||
| 10-9 |
| x-10-2 |
| 10-9 |
| x-10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
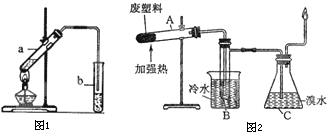
| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
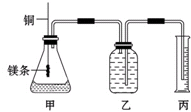 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com