
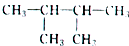 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;分析 (1)根据常见的有机物官能团判断该有机物分子中含有的官能团名称;
(2)根据烯烃的命名原则进行解答,注意编号从距离碳碳双键最近的一端开始;
(3)①由链式结构可知含双键和三键;
②它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,则4个C形成正四面体结构.
解答 解:(1)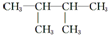 是烷烃,选取最长碳原子的为主链,主链含有4个,从离甲基最近的一端编号,写出名称为:2,3-二甲基丁烷;故答案为:2,3-二甲基丁烷;
是烷烃,选取最长碳原子的为主链,主链含有4个,从离甲基最近的一端编号,写出名称为:2,3-二甲基丁烷;故答案为:2,3-二甲基丁烷;
(2)依据系统命名方法,结合名称写出结构简式,3-甲基-2-戊烯的结构简式是:CH3CH=C(CH3)CH2CH3;故答案为:CH3CH=C(CH3)CH2CH3;
(3)①由链式结构,可知含双键和三键,结构简式为HC≡C-CH═CH2,故答案为:HC≡C-CH═CH2;
②它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,则4个C形成正四面体结构结构式为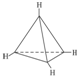 ,故答案为:正四面体.
,故答案为:正四面体.
点评 本题考查了有机物的命名,分子式判断、同分异构体书写等,题目难度中等,注意掌握常见有机物的命名原则,熟悉常见的官能团结构、名称.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4$\stackrel{高温}{→}$C+2H2 | B. | 2HI+Cl2═2HCl+I2 | ||
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | D. | CH2Cl+Cl2$\stackrel{光}{→}$CH2Cl2+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
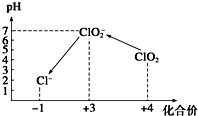 ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:As3->S2->C1- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com