
【题目】下列说法正确的是![]()
A.酸碱中和滴定时,滴定管和锥形瓶在使用前均需用待装液润洗
B.清洗碘升华实验所用试管,先用稀盐酸清洗,再用水清洗
C.实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
D.配制![]() 溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
【答案】D
【解析】
A、酸碱中和试验中,锥形瓶不能润洗,否则导致待测液中溶质的物质的量存在误差;
B、碘易溶于酒精,但是不溶于盐酸中;
C、碘元素在海水中只有化合态,没有游离态,海带提取单质碘需将碘离子氧化成碘单质;
D、硝酸铵溶于水吸热,冷的溶液体积偏小,恢复室温后所得溶液体积偏大。
A、中和滴定中,锥形瓶不能用待测液润洗,否则导致待测液中溶质的物质的量偏大,消耗的标准液体积偏大,测定结果偏高,故A错误;
B、碘易溶于酒精,清洗碘升华实验所用试管,先用酒精清洗,再用水清洗,故B错误;
C、海水中只有化合态的碘,实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤,然后需将碘离子氧化为碘单质,在提取的过程中用的氧化剂可以是
过滤,然后需将碘离子氧化为碘单质,在提取的过程中用的氧化剂可以是![]() ,然后再萃取,故C错误;
,然后再萃取,故C错误;
D、![]() 溶于水后吸收热量,未恢复至室温就转移并定容,最终配制溶液的体积偏大,溶液的浓度偏小,故D正确;
溶于水后吸收热量,未恢复至室温就转移并定容,最终配制溶液的体积偏大,溶液的浓度偏小,故D正确;
故选:D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
CH3OH(g)+H2O(g)。实验测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示。
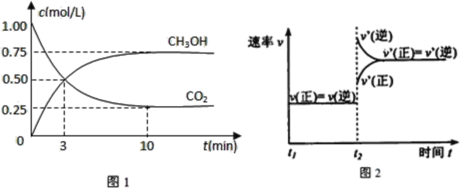
①从反应开始到平衡,氢气的平均反应速率v(H2)=__;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是__热(填“吸”或“放”)反应。
③该反应的平衡常数K为__(保留两位小数)。若提高温度到800℃进行,达平衡时,K值__(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为__。
Ⅱ.(2)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8kJmol-1
CH3OH(g) △H=-90.8kJmol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJmol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJmol-1
CO2(g)+H2(g) △H=-41.3kJmol-1
总合成反应的热化学方程式为__。
(3)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__(填字母代号)。
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL-1 | 0.44 | 0.60 | 0.60 |
此时,v(正)__v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
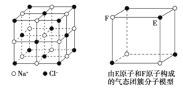
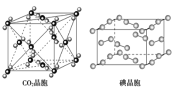
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子的分子式为E4F4或F4E4
C.在CO2 晶体中,一个CO2 分子周围有4个CO2 分子紧邻
D.在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数,下列说法正确的是( )
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4mol A和2mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
4C(s)+2D(g)。平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=![]()
C.温度一定时,当溶液中c(Ag+ )· c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+ )=x mol·L﹣1,c(B—)=y mol·L﹣1,则Ksp值为4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各实验操作中错误的是![]()
![]() 实验室制乙烯时,温度计水银球应插入混合液中
实验室制乙烯时,温度计水银球应插入混合液中
![]() 配制氢氧化铜悬浊液时,向硫酸铜溶液中逐滴滴加氢氧化钠溶液,直到沉淀完全为止
配制氢氧化铜悬浊液时,向硫酸铜溶液中逐滴滴加氢氧化钠溶液,直到沉淀完全为止
![]() 配制银氨溶液时,向硝酸银溶液中逐滴滴加氨水,边滴边振荡,直到生成的沉淀溶解为止
配制银氨溶液时,向硝酸银溶液中逐滴滴加氨水,边滴边振荡,直到生成的沉淀溶解为止
![]() 用醋酸、碳酸氢钠、苯酚钠和必须的仪器可以检验苯酚、醋酸、碳酸的酸性强弱
用醋酸、碳酸氢钠、苯酚钠和必须的仪器可以检验苯酚、醋酸、碳酸的酸性强弱
![]() 做过银镜反应的试管用浓硝酸清洗
做过银镜反应的试管用浓硝酸清洗
![]() 卤代烃与氢氧化钠溶液共热后,再滴入硝酸银溶液,可检验卤原子的种类
卤代烃与氢氧化钠溶液共热后,再滴入硝酸银溶液,可检验卤原子的种类
![]() 若苯酚不慎沾到皮肤上,应立即用酒精洗涤
若苯酚不慎沾到皮肤上,应立即用酒精洗涤
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
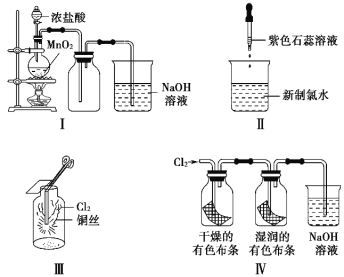
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是重要的饮用水源,污染物通过饮用水可直接毒害人体。也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为________,由水电离出的c(OH-)=_______mol/L
(2)纯水在100℃时,pH=6,该温度下1mol/L的NaOH溶液中,由水电离出的 c(OH-)=_______mol/L。
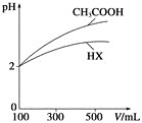
(3)体积均为100mL、pH均为2的CH3COOH溶液与一元酸HX溶液,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数___(填”大于””小于”或“等于”)CH3COOH的电离平衡常数。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K==1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.610-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为______
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中 c(CH3COO-)-c(Na+)=_____(填精确值)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。下列说法正确的是

A.图中属于“氮的固定”的是k和l
B.表示循环中发生非氧化还原反应的过程只有a
C.若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂的物质的量之比为2:1
D.若反应i是在酸性条件下由 NO3-与Fe2+的作用实现,则该反应的离子方程式为3Fe2++NO3- +4H+ = 3Fe3+ + NO↑ +2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com