
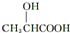 )有关的化学方程式:
)有关的化学方程式: ,
, ;
; ,
, ;
; ,
, ;
;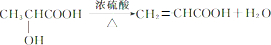 ,
,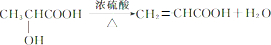 ;
; ,
, .
.


科目:高中化学 来源: 题型:
| A、(1)不移动(2)向左移 |
| B、(1)向右移(2)不移动 |
| C、(1)向右移(2)向左移 |
| D、(1)不移动(2)向右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一密闭容器中发生反应N2+3H2??2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
在一密闭容器中发生反应N2+3H2??2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
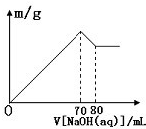 往100mL未知AlCl3和MgCl2的混合溶液中滴加入0.1mol/L的NaOH溶液,生产沉淀的质量随加入NaOH溶液体积的变化关系如图所示,求AlCl3和MgCl2的物质的量浓度.
往100mL未知AlCl3和MgCl2的混合溶液中滴加入0.1mol/L的NaOH溶液,生产沉淀的质量随加入NaOH溶液体积的变化关系如图所示,求AlCl3和MgCl2的物质的量浓度.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺人Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺人Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| B、工业上制取单质硅 |
| C、Na2O2作呼吸面具中的供氧剂 |
| D、一定条件下用硫酸铜制Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com