
| A、pH=12的溶液中:K+、Na+、Br-、AlO2- |
| B、无色溶液中:H+、K+、MnO4-、C2O42- |
| C、c(Fe3+)=0.1mol?L-1的溶液中:K+、H+、SCN-、I- |
| D、由水电离出的c(OH-)=1.0×10-13mol?L-1的溶液中:Na+、NH4+、SO42-、HCO3- |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ |
| 0.1mol?L-1氨水 | pH=11氨水 | 0.1mol?L-1盐酸 | pH=3盐酸 |
| A、①稀释到原来的100倍后,pH与②相同 | ||
| B、等体积①③混合、等体积②④混合所得的溶液都呈酸性 | ||
C、①②中分别加入少量CH3COONa固体,
| ||
| D、将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则:c(NH4+)>c(Cl-)>c(NH3?H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素A、B、C、D在周期表中的位置如图1所示,B、D最外层电子数之和为12,二者可形成DB2、D
短周期元素A、B、C、D在周期表中的位置如图1所示,B、D最外层电子数之和为12,二者可形成DB2、D| B | 3 |
| H | 2 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Na | Mg | Si | |
| I1/kJ?mol-1 | 496 | 738 | 787 |
查看答案和解析>>
科目:高中化学 来源: 题型:
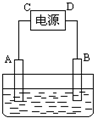 有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答:
有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH+OH-═CH3COO-+H2O |
| B、H2O+H2O?H3O++OH- |
| C、NH4++H2O?NH3?H2O+H+ |
| D、PO43-+H2O?HPO42-+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com