
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴 加酚酞. | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞.镁带用砂纸打磨后与2mol/L盐酸反应. | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
| 探究同一周期从左到右元素 金属性的递变规律 | 探究同一主族内从上到下元素 非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
分析 (1)(2)要证明元素的金属性强弱,可利用金属与酸(或水)的反应;
要证明元素的非金属性强弱,可利用单质之间的置换反应,非金属性强的元素的单质可以置换非金属弱的;
(3)钠与水反应生成NaOH和氢气;
(4)Al与酸中的氢离子反应生成氢气;
(5)氯气与溴化钠发生置换反应生成氯化钠和单质溴.
解答 解:(1)要证明元素的金属性强弱,可利用金属与酸(或水)的反应,反应越剧烈,金属性越强;
钠与冷水反应,再向反应后溶液中滴加酚酞,浮于水面,熔成小球,迅速向四处游动,溶液变成红色;
镁带与沸水反应,再向反应后溶液中滴加酚酞;镁与2mol/L盐酸反应;Mg与热水反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧;
铝片与2mol/L盐酸反应,产生大量气泡、气体可以燃烧;
由此可知,金属与酸(或水)的反应剧烈程度:Na>Mg>Al,即金属性:Na>Mg>Al;
NaBr溶液中加入氯水和CCl4,下层溶液变橙色,说明氯气置换了溴,则非金属性Cl>Br;
NaI溶液中加入溴水和CCl4,下层溶液变紫色,说明溴置换了碘,则非金属性Br>I;所以非金属性:Cl>Br>I;
则实验操作与实验现象对应为:
| 探究同一周期从左到右元素金属性的递变规律 | 探究同一主族内从上到下元素非金属性的递变规律 | |||||||
| Ⅰ | 1 | 5 | 8 | 4 | 7 | |||
| Ⅱ | E | B | C | F | D | |||
| 探究同一周期从左到右元素金属性的递变规律 | 探究同一主族内从上到下元素非金属性的递变规律 | |||||||
| Ⅰ | 1 | 5 | 8 | 4 | 7 | |||
| Ⅱ | E | B | C | F | D | |||
点评 本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
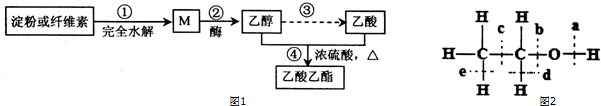
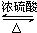 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为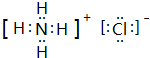 .
.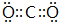 .z单质的电子式为
.z单质的电子式为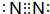 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为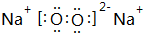 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | ①将一小块金属钠放入滴有酚酞溶液的冷水中 ②将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. ③将一小段镁带投入稀盐酸中 ④将一小片铝投入稀盐酸中 |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com