
分析 (1)根据n=cV计算出硫酸铜、硫酸的物质的量,再计算出混合液中硫酸根离子的总物质的量,然后根据c=$\frac{n}{V}$计算出稀硫酸的浓度;等体积混合后溶液中铜离子、氢离子浓度减半,据此计算出混合液中铜离子、氢离子浓度;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-).
解答 解:(1)把1.0mol•L-1 CuSO4溶液和a mol•L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合液中硫酸根离子浓度为:c(SO42-)=$\frac{1}{2}$c(CuSO4)+$\frac{1}{2}$c(H2SO4)=1.5mol•L-1,带入数据解得:a=2;
等体积混合后溶液中c(Cu2+)=c(CuSO4)=$\frac{1}{2}$×1.0mol/L=0.5mol/L;c(H+)=$\frac{1}{2}$×c(H2SO4)×2=2mol/L,
故答案为:2;0.5;2;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
故答案为:1.5.
点评 本题考查混合物反应计算、物质的量浓度的计算,题目难度中等,注意对公式的理解与灵活运用,注意理解稀释定律,(2)中注意根据守恒解答.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 10min内,T1时CH4的化学反应速率比T2时小 | |
| B. | T1<T2 | |
| C. | 平衡常数:K(T1)<K(T2) | |
| D. | a<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2COOH | B. | HCOOCH2CH3 | C. | CH3COOCH3 | D. | CH3COCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在 | |
| B. | 先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Be2+中的质子数和电子数比 | |
| B. | ${\;}_{1}^{3}$H原子中的中子数和电子数 | |
| C. | Na2CO3晶体中阳离子和阴离子个数比 | |
| D. | BaO2(过氧化钡)固体中阴离子和阳离子个数比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水用Fe作为催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下得到纯净的CH3Cl | |
| D. | 乙烯通入溶有Br2的CCl4溶液可得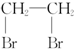 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gD2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com