


科目:高中化学 来源: 题型:

A、0-t1时,v(Y)=
| ||
| B、t2时刻改变的条件可能是压强或催化剂 | ||
| C、该反应的正反应为放热反应 | ||
| D、该反应中Z一定为产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
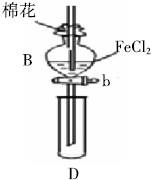 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 既有Fe3+又有Fe2+ | 有SO42- |
| 乙 | 有Fe3+ 无Fe2+ | 有SO42- |
| 丙 | 有Fe2+ 无Fe3+ | 有Fe2+ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 原子的最外层电子数相差1.请回答下列问题:
原子的最外层电子数相差1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

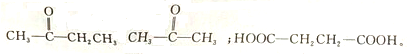
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com