
���ֶ�����Ԫ�ص�ijЩ��Ϣ�����ʾ��
Ԫ�� | �й���Ϣ |
X | ����������Ӧ��ˮ������������̬�⻯�ﷴӦ������ |
Y | M������3������ |
Z | ������Ԫ����ԭ�Ӱ뾶��������Ԫ�� |
W | �䵥���ǵ���ɫ���� |
Q | �������������۴�����Ϊ6 |
����˵����ȷ����
A�������ӵİ뾶��С˳��Ϊ��W��Q��Z��Y
B��Z������������ȼ�պ�IJ��ﲻ��ʹƷ����Һ��ɫ
C�������۵�ߵ͵�˳��Ϊ��Z��Y��X
D��Z��WԪ��ֻ���γ�ԭ�Ӹ�����Ϊ2:1�Ļ�����
A
��������
�����������������֪��X������������Ӧ��ˮ������������̬�⻯�ﷴӦ�����Σ���XΪ��Ԫ�أ�Y Ԫ��ԭ��M������3�����ӣ���YΪ��Ԫ�أ�ZԪ���Ƕ�����Ԫ����ԭ�Ӱ뾶��������Ԫ�أ���ZΪ��Ԫ�أ�W�ĵ����ǵ���ɫ���壬WΪ��Ԫ�أ�Q�������������۴�����Ϊ6����QΪ��Ԫ�ء� A�������ӵİ뾶��С˳��Ϊ��S2����Cl����N3����Al3������ȷ��B���Ƶ�����������ȼ�պ�IJ���������ƾ���ǿ�����ԣ���ʹƷ����Һ��ɫ������ C�������۵�ߵ͵�˳��Ϊ��Al ��Na��N2������D��������Ԫ�ؿ��γ�ԭ�Ӹ�����Ϊ2:1�Ļ��������Ƽ������ƣ�����
���㣺����Ԫ���ƶϡ�Ԫ�������ɼ�������ʵ����ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ұ�д�����ĩ���Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��2CO(g)+O2(g)=2CO2(g) ��H= ��566 kJ?mol��1
Na2O2(s)+CO2(g) = Na2CO3(s)+1/2O2(g) ��H= ��226 kJ?mol��1
���б�����ȷ����(NA��������٤����������ֵ) ( )
A��1molCOȼ��ʱ�ų�������Ϊ283 kJ?mol��1
B��Na2O2(s)+CO(g) = Na2CO3(s) ��H= ��509 kJ?mol-1
C��Na2O2(s)��CO2(g)��Ӧ�ų�226 kJ����ʱ����ת����Ϊ2NA
D��Na2O2��Na2CO3���������Ӹ����Ȳ�ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�����еڶ�ѧ�ڸ߶���ѧ���п��ԣ�B�����Ծ��������棩 ���ͣ�ѡ����
��ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ���ǣ�������

A.��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
B.�Թ�b�е������¶˹ܿڲ��ܽ���Һ���Ŀ���Ƿ�ֹʵ������в�����������
C.ʵ��ʱ�����Թ�a��Ŀ��֮һ�Ǽ�ʱ����������������ʹ��Ӧ���������������ķ����ƶ�
D.�Թ�b�б���Na2CO3��Һ��������������������������������������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㽭ʡ�����п����������ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z��WΪ������Ԫ�أ�ԭ�Ӱ뾶X��Y��Z��W��X��Y��Z����ͬһ���ڣ�Z��W����ͬһ���壬X��Y��Zԭ������֮��Ϊ40��X�Ƕ������г�ϡ������Ԫ����뾶����Ԫ�ء�����˵����ȷ����
A����X��Y��W�γɵĻ�����ΪXYW2������ˮ��Һ�����Լ���
B��Y������������Ӧ��ˮ����һ���Ǽ�
C���ȶ��ԣ�W���⻯�Z���⻯��е㣺Z���⻯�W���⻯��
D��X��Y�������ᄃ������һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㽭ʡ������ѧ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��14�֣�ij������;�㷺�������������Լ���ýȾ��������������ԭ�ϡ����ⶨ��������Ԫ�أ�Ħ������Ϊ482g/mol��Ϊ��һ��ȷ��������ɣ�ij��ѧ��ȤС����������ʵ�飺
��ȡ48.20g����������ˮ�����100mL��Һ��������Һ���ػ�ɫ��
��ȡ������Һ50mL���Թ��У�����������0.1mol/LNaOH��Һ�������ȣ����������徭�����ͨ��Ũ�����У�Ũ��������0.85g�������ĺ��ɫ�����������ˡ�ϴ�ӡ����պ��4.00g���塣
����ȡ������Һ50mL���Թ��У�����������BaCl2��Һ����������������İ�ɫ���� 23.30g��
��ش��������⣺
��1��ʵ����в�������ĵ���ʽ ��
��2�������ʵĻ�ѧʽΪ �������йظ����ʵ���;�������� ��
A����Ѫ�� B����ˮ�� C�����ӷ�ˮ�ļ���Լ� D������
��3����������Һ����μ�������������Һ������Ԫ����ȫ����ʱ�Ļ�ѧ��Ӧ����ʽ ��
��4����SO2����ͨ������ʵ���Һ�п��Թ۲쵽��ʵ�������� ��д���÷�Ӧ�����ӷ���ʽ ��
��5��Ϊ�˽�һ����֤����������Ԫ�صĻ��ϼۣ�ijͬѧ���������ʵ�鷽����ȡ�����������Թ��У���ˮ����ܽ⣬�μ����軯����Һ������Һ��Ѫ��ɫ������֤����������һ������Fe3+�������۸�ʵ������Ƿ���� ������������ߡ����������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㽭ʡ�����и�����ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣��о�CO2��CH4�ķ�Ӧʹ֮ת��ΪCO��H2���Լ���ȼ��Σ������������ЧӦ������Ҫ�����塣
��1����֪����2CO(g)+O2��g����2CO2(g)����H����566 kJ��mol-1
��2H2(g)+O2��g����2H2O(g)����H����484kJ��mol-1
��CH4(g)+2O2(g)��CO2(g)+2H2O(g)����H����802kJ��mol-1
��CH4(g)+CO2(g) 2CO(g)+2H2(g)����H������kJ��mol-1
2CO(g)+2H2(g)����H������kJ��mol-1
���������ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol����-1��CH4��CO2����һ�������·�����ӦCH4(g)+CO2(g) 2CO(g)+2H2(g)�����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
2CO(g)+2H2(g)�����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��

?��ͼ��֪��P1 ��P2�� P3 ��P4 �ɴ�С��˳����
?��ѹǿΪP4��1100��������£��÷�Ӧ5minʱ�ﵽƽ���X������CO��ʾ�÷�Ӧ������Ϊ �����¶��£���Ӧ��ƽ�ⳣ��Ϊ ����
��3��CO��H2�ڹ�ҵ�ϻ�����ͨ����ӦC(s)+H2O(g)  CO(g)+H2 (g)����ȡ��
CO(g)+H2 (g)����ȡ��
���ں��º����£�����ӷ�Ӧ���������ƽ�⣬���϶�ƽ���Ѵﵽ����
A����ϵѹǿ���ٱ仯 B��H2��CO�����ʵ���֮��Ϊ1 ��1
C�����������ܶȱ��ֲ��� D. ����ƽ����Է�������Ϊ15���ұ��ֲ���
�� ��ij�ܱ�������ͬʱͶ���������ʣ�2minʱ�ﵽƽ�⣬�����������1mol H2O(g)��1mol CO(g)��
2.2molH2(g)��һ������C(s)�������ʱ����ϵ��ѹ��ƽ���� ����������桱����Ӧ�����ƶ�����5minʱ�ﵽ�µ�ƽ�⣬������ͼ�л���2��5min������������ƽ����Է��������ı仯���ߡ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㽭ʡ�����и�����ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Ԫ�ᣨH2A����ˮ�еĵ��뷽��ʽΪ��H2A = H+ + HA- HA- H+ + A2- ��Ka=1.0��10-2��������˵����ȷ����
H+ + A2- ��Ka=1.0��10-2��������˵����ȷ����
A����0.1 mol��L-1��H2A��Һ�У�c��H+���� 0.12 mol��L-1
B����0.1 mol��L-1��Na2A��Һ�У�c��A2-��+ c��HA-��+ c��Na+��= 0.2 mol��L-1
C���ֱ�ͬŨ�ȣ�0.1 mol��L-1����NaHA��Na2A��Һ�������ϣ���pHһ��С��7
D��0.1 mol��L-1��NaHA��Һ������Ũ��Ϊ��c��Na+����c��H+����c��HA-����c��A2-����c��OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㽭ʡ������ҵˮƽ������Ӧ�Բ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������������е��л������˵������ȷ����
A����ú�����з���������ױ����л���
B��ʳ���dz��õĵ�ζƷ�����к�������
C����֬��������Ӧ�����Ե������½���
D������͵����ʶ���������Ҫ��Ӫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�㽭ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���� �� ��
A���������ױ��Ľṹ��ʽΪ 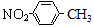
B�����ع��͡���ֹʳ�ã������������Ʒ���
C�������¶ȣ�һ���ʹ����ӵİٷ������������Ӧ��������
D��H2(g) +Cl2(g)==2HCl(g) ��H��-184.6 kJ/mol����������ȼ���ȷ���ʽ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com