
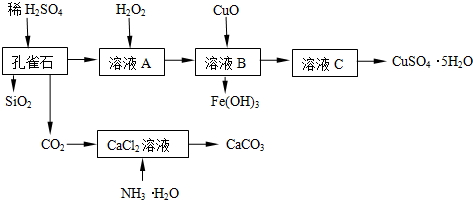
分析 由制备实验流程可知,Cu2(OH)2CO3、少量Fe的氧化物均与硫酸反应,只有SiO2不反应,溶液A中含Cu2+、Fe2+、Fe3+,加H2O2的溶液将亚铁离子氧化为铁离子,则溶液B中含Cu2+、Fe3+,加CuO促进铁离子水解转化为沉淀,所以溶液C中主要为硫酸铜,蒸发浓缩、冷却结晶得到CuSO4•5H2O;
制备CaCO3时,先通入氨气,增大二氧化碳的溶解,生成碳酸铵与氯化钙反应生成碳酸钙、氯化铵,则过滤可得到CaCO3,以此来解答.
解答 解:(1)若检验该溶液中Fe3+,可加入KSCN,溶液变为红色,向溶液A加入H2O2将亚铁离子氧化为铁离子,选用H2O2而不用Cl2的原因是不引入新杂质Cl-,
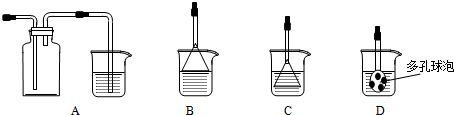
故答案为:D; 没有引入其它杂质离子;
(2)由溶液C获得CuSO4•5H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是玻璃棒,起引流作用,
故答案为:引流;
(3)使CaCl2溶液中生成CaCO3,须在溶液显碱性的条件下通CO2,为使溶液显碱性,可向溶液中先通NH3,发生CO2+CaCl2+2NH3•H2O=CaCO3↓+2NH4Cl+H2O,
NH3极易溶于水,吸收多余NH3时要防止倒吸,图中B的倒扣漏斗,A中气体收集时导管应短进,C、D中气体直接与水接触而不能防止倒吸,
故答案为:CO2+CaCl2+2NH3•H2O=CaCO3↓+2NH4Cl+H2O;B.
点评 本题考查物质制备实验方案的设计,为高频考点,把握制备实验流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意除杂不能引入新杂质及防倒吸装置的选择,题目难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 称取7.68gCuSO4,加入500mL水 | |
| B. | 称取12.5g胆矾,配成480mL溶液 | |
| C. | 称取8.0gCuSO4,加入到500mL水中配成溶液 | |
| D. | 称取12.5g胆矾,配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素的摩尔质量为 282 | |
| C. | 56.4g青蒿素中所含氧原子数目为 6.02×1023个 | |
| D. | 青蒿素中 C、H、O元素的质量比为 15:22:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
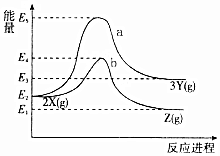
| A. | X→Y反应的活化能为E5 | |
| B. | 加入催化剂曲线a变为曲线b | |
| C. | 升高温度增大吸热反应的活化能,从而使化学反应速率加快 | |
| D. | 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯乙烷与四氯乙烷的同分异构体数相同 | |
| B. | 在光照条件下,乙烷与氯气反应不能制备纯净的二氯乙烷 | |
| C. | 二氯乙烷和硝酸银溶液反应产生白色沉淀 | |
| D. | 二氯乙烷发生消去反应可以得到乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
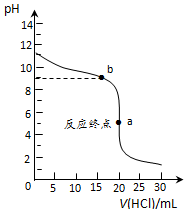
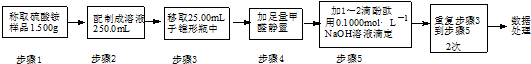
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
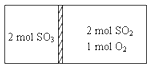 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )| A. | 恒温条件下,达到平衡容器两边SO3的体积分数相同 | |
| B. | 恒温条件下,容器中两边的吸收或放出的热量数值之和小于为196kJ | |
| C. | 若容器为绝热,达到平衡时右室反应速率等于左室反应速率 | |
| D. | 若容器为绝热容器,右室中SO2的转化率与左室SO3的转化率之和小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1 mol PbS冶炼成Pb理论上至少需要6 g碳 | |
| B. | 浮选法富集方铅矿的过程属于化学变化 | |
| C. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| D. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com