
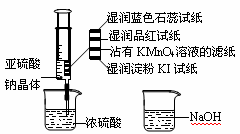
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润KI-淀粉试纸未变蓝,说明SO2的氧化性强于I2
D.品红试纸、沾有KMnO4溶液的滤纸均褪色,证明了SO2的漂白性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸 盐。
盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。
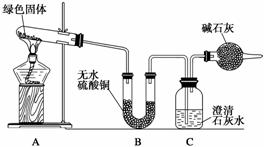
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。
观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是______________________________________________。
(2)加热后试管中剩余的黑色物质是________________________________________。
(3)假设该绿色物质是一种纯净物,则其化学式可能是________________________,加热分解的化学方程式为________________________________________________________
__________________________________________ ______________________________。
______________________________。
(4)上述实验步骤③中的反应的离子方程式为__________________________________
________________________________________________________________________。
(5)实验装置最后的干燥管的作用是_________________________________________。
(6)如果将B、C两装置对调,能否达到实验目的________(填“能”或“不能”),为什么?________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把Ba(OH)2溶液滴入明矾溶液中,使SO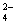 全部转化成BaSO4沉淀,此时铝元素
全部转化成BaSO4沉淀,此时铝元素
的主要存在形式是
 A.Al3+ B.Al(OH)3 C.AlO2— D.Al3+ 和Al(OH)3
A.Al3+ B.Al(OH)3 C.AlO2— D.Al3+ 和Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
某一无色透明溶液中只可能存在H+、Ba2+、Mg2+、Cu2+、OH-、HCO3-、
CO32-、NO3-、SO42- 中的一种或几种。已知该溶液能与Al反应放出H2
(1)若反应生成Al3+,则原溶液中一定存在 可能存在的离子有
(2)若反应生成AlO2- ,则原溶液中一定存在 可能存在的离子有
查看答案和解析>>
科目:高中化学 来源: 题型:
已知空气—锌电池的电极反应为:锌片:Zn+2OH--2e- = ZnO+H2O;
碳棒:1/2 O2+H2O+2e- = 2OH-,据此判断,锌片是
A.正极,并被还原 B.正极,并被氧化 C.负极,并被还原 D.负极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应中,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键形成的是
A. 2Na2O2 + 2H2O == 4NaOH + O2↑ B. Mg3N2 + 6H2O == 3Mg(OH)2 + 2NH3↑
C. Cl2 + H2O == HCl + HClO D. NH4Cl + NaOH== NaCl+ NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液体积是
A.60 mL B.45 mL C.30 mL D.15 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R表示)的单质能与NaOH溶液反应生 成盐(Na2RO3)和氢气。
成盐(Na2RO3)和氢气。
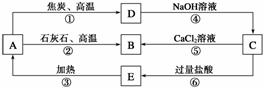
请回答下列问题:
(1)写出各物质的化学式:A__________;B__________;C__________;D__________;E__________。
(2)写出反应①的化学方程式:____________________________________________,
该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:__________________________________________。
(4)写出反应⑤的离子方程式:___________________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关的离子方程式或化学方程式中正确的是( )
A.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO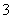 +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
B.磷酸一氢钠溶液水解:HPO +H2OPO
+H2OPO +H3O+
+H3O+
C.将2 mol SO3气体通入一密闭容器中,达平衡后吸收Q kJ热量,则该反应的热化学方程式为2SO3(g)2SO2(g)+O2(g) ΔH=+Q kJ/mol
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2,充分反应:4Fe2++2Br-+3Cl2===4Fe3++6Cl-+Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com