
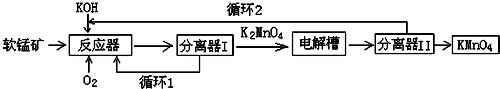
分析 软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4.即在碱性条件下用氧气氧化MnO2得到K2MnO4,生成的二氧化锰循环使用,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,生成的KOH循环使用,
(1)碱性条件下用氧气氧化MnO2得到K2MnO4,根据得失电子守恒和原子守恒写出相应的方程式;
(2)氧化铝是两性氧化物,氧化铝能和强碱反应生成偏铝酸盐和水,所以会导致KOH消耗量偏高.
(3)在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,阴极上水得电子发生还原反应生成氢气和氢氧根离子,阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子.
(4)根据题干信息可知反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,根据原子守恒书写化学反应方程式,根据方程式可知3molK2MnO4参加反应生成2molKMnO4、1molMnO2,据此判断氧化剂与还原剂的质量之比;电解法阳极都生成KMnO4,产率更高;
(5)发生反应:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式计算样品中草酸的质量,进而计算草酸的质量分数.
解答 解:(1)二氧化锰和氢氧化钾、氧气发生反应,生成锰酸钾和水,Mn(+4→+6),O(0→-2),反应的化学方程式为4KOH+2MnO2+O2=2K2MnO4+2H2O,
故答案为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,氧化铝和强碱反应生成偏铝酸盐和水,反应的化学方程式为2KOH+Al2O3=2KAlO2+H2O,所以会导致KOH消耗量偏高,
故答案为:偏高;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,即MnO42--e-=MnO4-,则电极总反应为:2MnO42-+2H2O$\frac{\underline{\;通电\;}}{\;}$2MnO4-+2OH-+H2↑,
故答案为:2MnO42-+2H2O$\frac{\underline{\;通电\;}}{\;}$2MnO4-+2OH-+H2↑;
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;
由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO4,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×$\frac{100ml}{20ml}$
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:$\frac{0.4662g}{0.500g}$×100%=93.2%,
故答案为:93.2%.
点评 本题考查实验制备方案的设计、物质分离与提纯方法的综合应用,题目难度中等,涉及化学实验基本操作、工艺流程、氧化还原反应滴定计算、物质含量的测定等知识,根据题中已知条件确定生成物并写出反应方程式明确原理是解题关键,是对学生综合能力的考查.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
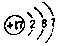 .
. .白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.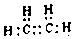 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023 | |
| B. | 标准状况下,22.4 L乙醇的共价键数为8×6.02×1023 | |
| C. | 标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023 | |
| D. | 100 mL 1 mol•L-1醋酸溶液中,H+的个数为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
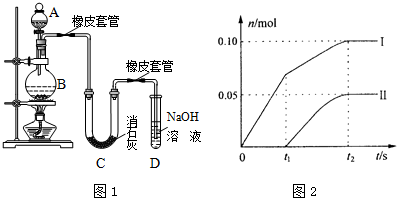
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
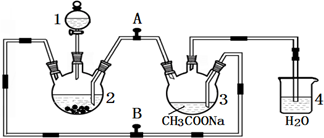 醋酸亚铬水合物
醋酸亚铬水合物查看答案和解析>>
科目:高中化学 来源: 题型:实验题
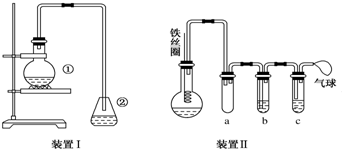
 .②中离子方程式为Br-+Ag+═AgBr↓.
.②中离子方程式为Br-+Ag+═AgBr↓. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
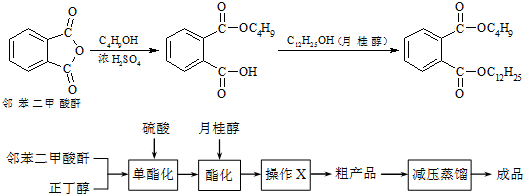
| 化合物 | 溶解性 | 熔点 | 沸点 |
| 邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
| 正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
| 月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
| 邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |
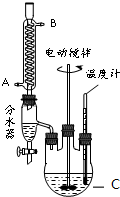
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com