
【题目】关于如图结构的说法不正确的是( )
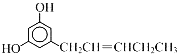
A. 分子中既有![]() 键又有π键
键又有π键
B. 碳原子有sp、sp2、sp3三种杂化方式
C. O—H键的极性强于C-H键的极性
D. 羟基中氧原子采取sp3杂化,VSEPR模型为四面体形
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】含氯的盐NaClO2是一种重要的含氯消毒剂。以下是过氧化氢法生产NaClO2的工艺流程图:
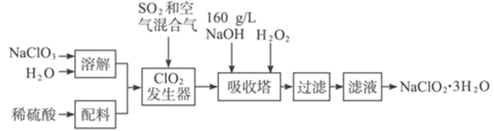
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
(1)NaClO2 的名称为_______________
(2)ClO2发生器中所发生反应的化学方程式为_______________,发生器中鼓入空气的作用可能是_______________(选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸; c.将NaClO3氧化成ClO2
(3)吸收过程中所用还原剂的还原性应适中,原因是_________,除H2O2外,还可以选择的还原剂是____________(填序号)
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
(5)将所得的NaClO2·3H2O晶体用冰水洗涤烘干,如何确定该晶体洗涤干净?
________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。
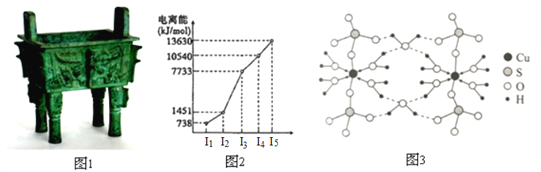
(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。
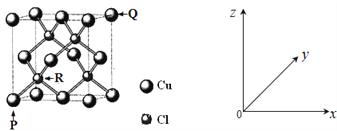
该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。根据上述反应式,完成下列题目。

(a)下列叙述正确的是________。
A.在使用过程中,电解质溶液的pH增大
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(b)写出电池的总反应式:___________________。
(2)某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
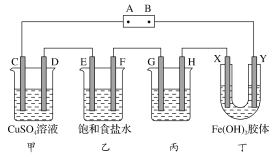
(a)电源A极的名称是________。
(b)甲装置中电解反应的总化学方程式:___________
(c)如果收集乙装置中产生的气体,两种气体的体积比是________。
(d)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”)。
(e)装置丁中的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是将化学能转化为电能的装置。
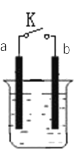
I. a为铜片,b为铁片,烧杯中是稀硫酸溶液
(1)当开关K断开时产生的现象为_______ ;当开关K闭合时,产生的现象为_________。
A.a不断溶解 B.b不断溶解 C.a上产生气泡 D.b上产生气泡 E.溶液逐渐变蓝
(2)闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述不正确的是___________ 。
A.溶液中H+浓度减小 B.正极附近![]() 浓度逐渐增大
浓度逐渐增大
C.溶液中含有FeSO4 D.溶液中![]() 浓度基本不变
浓度基本不变
II.FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为 ________ ,若将此反应设计成原电池,请写出该原电池负极电极反应为_______,正极电极反应为______。
III.如图是氢氧燃料电池构造示意图。
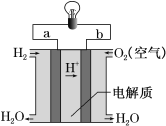
下列说法不正确的是______
A.a极是负极
B.电子由b通过溶液流向a
C.该电池总反应是2H2+O2=2H2O
D.氢氧燃料电池是环保电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或实验方案设计正确的是( )
A. 用裂化汽油萃取碘酒中的碘
B. 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液用冰盐水充分冷却
C. 实验室制乙炔时用饱和食盐水与电石反应,并用硫酸铜溶液除杂质
D. 向乙醇和苯酚混合物加入NaOH溶液,混合后振荡,然后静置分液从而分离它们
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活等各个领域有着广泛的应用。
(1)钛具有良好的金属性能。钛基态原子中电子占据能级个数为______。与钛同周期的元素中,基态原子的未成对电子数与钛相同的还有______种。钛比钢轻、比铝硬,是一种新兴的结构材料,钛硬度比铝大的可能原因是________。
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,该晶胞中N、Ti之间的最近距离为a×10-10cm,则该氮化钛的密度为_________g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是尚子晶体,其晶格能可通过图(a)的Bom-Haber循环计算得到。

Li原子的第一电离能为______kJ·mol-1,O==O键键能为______kJ·mol-1,Li2O晶格能为_______kJ·mol-1。
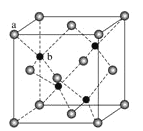
(4)Zn可形成多种化合物,其中立方ZnS晶胞结构如下图,其阴离子(S2-)按面心立方密堆积排布,立方ZnS的配位数与NaCl不同,这是由__________因素决定的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质:

(1)实验室制备乙炔的化学方程式是_______________________________;
(2)实验过程中,为减缓生成乙炔的速率,通常采取的措施是:___________________________________________________________;
(3)B中试剂是 ;
(4)若C中试剂是溴水,可以观察到的现象是_________________。
Ⅱ.利用上述装置还可以验证醋酸、苯酚、碳酸的酸性强弱。
(1)A中固体试剂是 (选填序号);
A.醋酸钠 B.碳酸氢钠 C.苯酚钠
(2)C中反应的化学方程式是____________________________________;
(3)有同学认为没有B装置,也可以验证酸性的强弱,你认为合理吗?
_____(填“合理”或“不合理”);若不合理,原因是:
______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com