
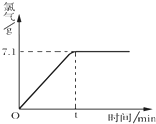
 氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:
氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:分析 由图可知,生成氯气为7.1g,结合n=$\frac{m}{M}$、质量守恒及反应计算.
解答 解:(1)生成氯气为7.1g,n(Cl2)=$\frac{7.1g}{71g/mol}$=0.1mol,由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH可知,n(H2)=0.1mol,生成氢气为0.1mol×2g/mol=0.2g,
故答案为:0.2;
(2)由反应可知,反应后溶质为NaOH,其质量为0.1mol×2×40g/mol=8g,溶液质量为$\frac{0.1mol×2×58.5g/mol}{10%}$-7.1g-0.2g=109.7g,反应后所得溶液中溶质的质量分数是$\frac{8g}{109.7g}$×100%=7.3%,
故答案为:7.3%.
点评 本题考查电解反应的计算,为高频考点,把握反应中物质的量关系、质量及原子守恒为解答的关键,侧重分析与计算能力的考查,注意图中生成氯气的质量及应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
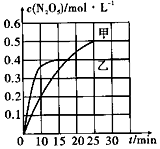 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
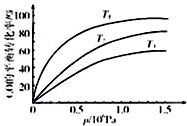 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
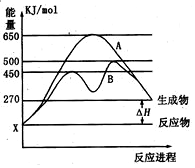 (1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1
(1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com