
合成氨反应为:N2(g)+3H2(g)2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化。图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

下列说法正确的是 ( )。
A.该反应为自发反应,由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
科目:高中化学 来源: 题型:
消毒剂在生产生活中有极其重要的作用,开发具有广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________ (填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O+H2O2===A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是_________________________________________。
(3)漂白剂亚氯酸钠(NaClO2)在常温下、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是 ( )。
A.上述生成Ni(CO)4的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时
v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol
·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃时,将气体X与气体Y置于一密闭容器中,反应生成气体Z,反应过程中各物质的浓度变化如图Ⅰ所示。保持其他条件不变,在T1、T2两种温度下,Y的体积分数变化如图Ⅱ所示。下列结论正确的是 ( )。
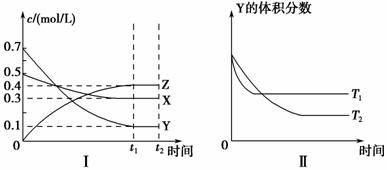
A.t2时,保持其他条件和物质状态不变,增大压强,化学平衡向逆反应方向移动
B.其他条件不变,若升高温度,正、逆反应速率均增大,且X的转化率增大
C.图Ⅱ中T1>T2,正反应是吸热反应
D.T ℃时,若密闭容器中各物质起始浓度为:0.4 mol/L X、0.4 mol/L Y、
0.2 mol/L Z,保持其他条件不变,达到平衡时Z的浓度为0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )。
A.化学变化过程是原子的重新组合过程
B.根据化学反应中的能量变化情况,化学反应可分为吸热反应和放热反应
C.化学反应中的能量变化多少与其反应物用量有关
D.化学反应中的能量变化都是以热能形式表现出来的
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )。
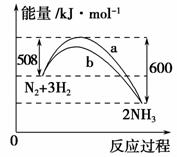
A.该反应的热化学方程式为N2+3H22NH3 ΔH=-92 kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热发生改变
D.温度、体积一定,1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
人类研究氢能源从未间断过,而热化学循环分解水制 H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2 和 O2 ,这是一种节约能源、节省反应物料的技术,下图是热化学循环制氢气的流程:

(1)实验测得,1 g H2 燃烧生成液态水放出 142.9 kJ 的热量,则表示氢气燃烧的热化学方程式为_______________________________________________
______________________________________________________________。
(2)整个流程参与循环的物质是________和________(填化学式),最难进行的反应是________(填序号)。
(3)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:
①CaBr2 + 2H2O===Ca(OH)2 + 2HBr↑;
②……
③HgBr2 + Ca(OH)2===CaBr2 + HgO+H2O;
④2HgO===2Hg + O2↑。
反应②的化学方程式为___________________________________________。
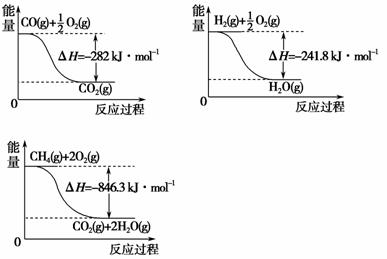
(4)合成氨用的 H2 可以甲烷为原料制得。有关化学反应的能量变化如下图所示,则 CH4 (g)与 H2O(g)反应生成CO(g)和 H2 (g)的热化学方程式为_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原油价格的下跌,加剧能源的过度开采,因此更要开展汽油的有机合成的研究。以下是一种合成汽油的路线:
已知:

(1)在反应①—⑥中,属于加成反应的是 ,B的分子式为 。
(2)A中官能团名称为 ,CCS法命名E的名称为 。
(3)写出下列反应方程式:E→F ;
H→G 。
(4)H也能与NaOH溶液反应,其反应方程式为: 。
(5)D的核磁共振氢谱有 组吸收峰。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com