
暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视.在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀.为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验.经组成分析,该粉末仅含有O、K、Fe三种元素.
另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g.
(1)3.96g化合物A中含有Fe元素的物质的量为0mol,含有钾元素的物质的量为mol.化合物A的化学式为;
(2)化合物A与H2O反应的离子方程式为:.
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案..
考点: 探究物质的组成或测量物质的含量;性质实验方案的设计.
分析: 在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,该红褐色沉淀为Fe(OH)3;可推知A含有Fe元素,A中仅含有O、K、Fe三种元素;取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g,则红棕色固体粉末1.60g为氧化铁,由铁元素守恒可知,3.96g化合物A含铁: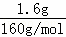 ×2=0.02mol,不含结晶水的盐10.44g为硫酸钾,3.96g化合物A中含钾:
×2=0.02mol,不含结晶水的盐10.44g为硫酸钾,3.96g化合物A中含钾: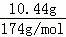 ×2﹣0.08mol=0.04mol,3.96g化合物A中含氧:
×2﹣0.08mol=0.04mol,3.96g化合物A中含氧: =0.08mol,故钾、铁、氧的个数比为:0.04mol:0.02mol:0.08mol=2:1:4,故A的化学式为:K2FeO4;高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,据此解答.
=0.08mol,故钾、铁、氧的个数比为:0.04mol:0.02mol:0.08mol=2:1:4,故A的化学式为:K2FeO4;高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,据此解答.
解答: 解:在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,该红褐色沉淀为Fe(OH)3;可推知A含有Fe元素,A中仅含有O、K、Fe三种元素;取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g,则红棕色固体粉末1.60g为氧化铁,由铁元素守恒可知,3.96g化合物A含铁: ×2=0.02mol,不含结晶水的盐10.44g为硫酸钾,3.96g化合物A中含钾:
×2=0.02mol,不含结晶水的盐10.44g为硫酸钾,3.96g化合物A中含钾: ×2﹣0.08mol=0.04mol,3.96g化合物A中含氧:
×2﹣0.08mol=0.04mol,3.96g化合物A中含氧: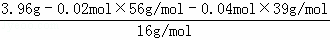 =0.08mol,故钾、铁、氧的个数比为:0.04mol:0.02mol:0.08mol=2:1:4,故A的化学式为:K2FeO4;高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,
=0.08mol,故钾、铁、氧的个数比为:0.04mol:0.02mol:0.08mol=2:1:4,故A的化学式为:K2FeO4;高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,
(1)根据以上分析,3.96g化合物A中含有Fe元素的物质的量为0.02mol,含有钾元素的物质的量为0.04mol.化合物A的化学式为K2FeO4;
故答案为:0.02;0.04;K2FeO4;
(2)由上述分析可知,A的化学式为:K2FeO4;高铁酸钾与水反应生成氧气和Fe(OH)3、氢氧化钾,反应方程式为4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑,离子方程式为4FeO42﹣+10H2O=4Fe(OH)3↓+3O2↑+8OH﹣,
故答案为:K2FeO4;4FeO42﹣+10H2O=4Fe(OH)3↓+3O2↑+8OH﹣;
(3)固定其他条件,改变温度,看析出沉淀的快慢,可取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢,
故答案为:取少量的样品放入试管加水溶解,分成两等份于两试管中,分别放在冷水和热水中,观察生成红褐色沉淀的快慢.
点评: 本题考查无机物推断,属于计算型推断,综合考查学生阅读题目获取信息的能力、计算能力、设计实验能力等,题目难度较大,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D四种金属片,
①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C.
根据上述情况判断四种金属的活泼由强到弱的顺序为()
A. DCAB B. CBAD C. BADC D. BACD
查看答案和解析>>
科目:高中化学 来源: 题型:
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl﹣+2H3AsO3+6H+═2As+3SnCl62﹣+6M,关于该反应的说法中正确的组合是()
①氧化剂是H3AsO3②还原性:Cl﹣>As③每生成7.5g As,还原剂失去的电子为0.3mol④M为OH﹣⑤SnCl62﹣是氧化产物.
A. ①③⑤ B. ①②④⑤ C. ①②③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol•L﹣1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是()
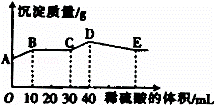
A. AB段发生反应的离子方程式为:Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O
B. BC段发生反应的离子方程式为:H++OH﹣=H2O
C. D点表示的沉淀的化学式为Al(OH)3、BaSO4
D. E点表示的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是()
A. 化学反应中的能量变化,都表现为热量的变化
B. 需要加热才能发生的反应,一定是吸收能量的反应
C. 释放能量的反应在常温下一定很容易发生
D. 是吸收能量的反应还是释放能量的反应,必须看反应物的总能量和生成物的总能量的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 苯不能使酸性KMnO4溶液退色,与甲烷性质相似,因此苯为饱和烃
B. 苯的结构简式为 ,有三个双键,可与溴水发生加成反应
,有三个双键,可与溴水发生加成反应
C. 苯的6个碳原子和6个氢原子在同一平面内
D. 将1mL苯和1mL水充分混合后静置,二者互溶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com