
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大、c(HF)减小,则$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$增大 | |
| C. | 稀释过程中,c(OH-)、$\frac{c({H}^{+})}{c(HF)}$均增大 | |
| D. | 溶液的KW、$\frac{c({F}^{-})}{c({H}^{+})}$、pH均不变 |
分析 根据HF属于弱电解质,则在加水不断稀释时,电离程度增大,电离平衡保持向正反应方向移动,并注意温度不变时,电离平衡常数不变来解答.
解答 解:A、因HF为弱酸,则浓度为0.1mol•L-1HF溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A错误;
B、因Ka(HF)=$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$,温度不变,其电离平衡常数不变,故B错误;
C、当HF溶液加水不断稀释,促进电离,c(F-)不断减小,Ka(HF)不变,则$\frac{c({H}^{+})}{c(HF)}$增大,HF溶液加水稀释,酸性减弱,c(OH-)增大,故C正确;
D、KW的大小只与温度有关,温度不变其不变;因稀释时一段时间电离产生等量的H+和F-,溶液的体积相同,则两种离子的浓度的比值不变,但随着稀释的不断进行,c(H+)不会超过10-7mol•L-1,c(F-)不断减小,则比值变小;加水稀释,酸性减弱,pH增大,故D错误;
故选C.
点评 本题考查弱电解质的稀释,明确稀释中电离程度、离子浓度、Ka的变化即可解答,本题难点和易错点是不断稀释时c(H+)不会超过10-7mol•L-1.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | NaCl固体 | C. | MgSO4固体 | D. | NaHSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


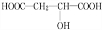 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$ +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
已知某可逆反应:mA(气)+nB(气)?xC(气)△H=QkJ•mol-1,在密闭容器中进行,如图表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )| A. | T1>T2,P1>P2,m+n>x,Q>0 | B. | T1>T2,P1<P2,m+n<x,Q<0 | ||
| C. | T1>T2,P1<P2,m+n<x,Q>0 | D. | T1<T2,P1>P2,m+n>x,Q<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、C和E形成的化合物
、C和E形成的化合物 、A、B和E形成的化合物
、A、B和E形成的化合物 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,Cl2的摩尔质量为71g | |
| B. | 氧化还原反应一定有氧元素参加 | |
| C. | 国际上规定,0.012kg 12C所含有的碳原子数约为1mol | |
| D. | Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com