
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R在化合物中显+1价 | B. | 最高价氧化物的水化物的碱性:X>R | ||
| C. | 原子半径:W<R<X | D. | R与Z可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
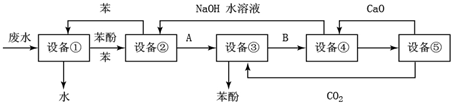 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
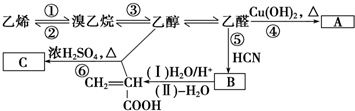
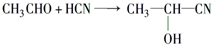 ;加成反应.
;加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
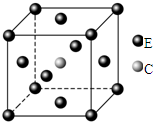 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn-2e-=Zn2+ | B. | Br2+2e-=2Br- | C. | 2Br--2e-=Br2 | D. | Zn2++2e-=Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X:它的原子中第三电子层比第二电子层少2个电子 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| C. | 元素Z:位于元素周期表中的第3周期,ⅢA族 | |
| D. | 元素W:它的单质硬度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
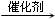
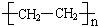 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com