
| A. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| B. | 碳酸氢钠溶液中加稀硫酸:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+ H2O | |
| D. | Cu(OH)2加入H2SO4:2H++Cu(OH)2=Cu2++2H2O |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.碳酸氢根离子不能拆开,应该保留整体形式;
C.漏掉了钡离子与硫酸根离子生成硫酸钡沉淀的反应;
D.氢氧化铜与硫酸反应生成硫酸铜和和水.
解答 解:A.氧化铁和稀硫酸反应生成硫酸铁和水,正确的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故A错误;
B.碳酸氢钠溶液中加稀硫酸,反应生成硫酸钠、二氧化碳气体和水,正确的离子方程式为:HCO3-+H+=H2O+CO2↑,故B错误;
C.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C错误;
D.Cu(OH)2加入H2SO4,反应的离子方程式为:2H++Cu(OH)2=Cu2++2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铜插入浓硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:2Fe3++Fe=3Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3+3Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中含有的
,其中含有的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
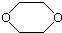 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得:| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na、Mg、Al的还原性逐渐减弱 | |
| B. | HCl、H2S、PH3、气态氢化物的稳定性逐渐增强 | |
| C. | NaOH、KOH的碱性逐渐增强 | |
| D. | O的原子半径比S的原子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大D的浓度 | B. | 减小C的浓度 | C. | 减小B的浓度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O═H++OH- | B. | 2H2O?H3O++OH- | C. | H2O?2H++O2- | D. | H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | Na2SO3 | C. | H2SO4 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
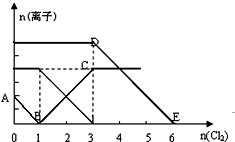 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com