
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
分析 (1)①根据配制一定物质的量浓度的溶液的配制步骤完成;
②根据正确称量0.4克氢氧化钠固体所需仪器进行解答;
(2)①根据指示剂为酚酞,滴定结束前溶液为无色,滴定结束时溶液变成红色进行判断滴定终点;
②根据滴定消耗的标准液的体积判断数据的有效性,然后计算出标准液的平均体积,最后根据标c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算出该盐酸的浓度;
③根据正确排去碱式滴定管中气泡的方法进行分析;
④根据操作对c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$的影响分析能够导致测定结果偏高的选项.
解答 解:(1)①配制100mL 0.10mol/L NaOH标准溶液的步骤为:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签,
故答案为:转移;定容;摇匀;
②称量0.4克氢氧化钠固体所需仪器,需要称量仪器天平(带砝码、镊子);氢氧化钠具有腐蚀性,应该放在烧杯中称量;还需要取氢氧化钠的仪器药匙,
故答案为:烧杯(或表面皿);药匙;
(2)①滴定结束前盐酸中滴入酚酞,溶液为无色,滴定结束时氢氧化钠过量,溶液变成红色,所以滴定终点现象为:最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色;
故答案为:最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色;
②三次滴定数据都是有效的,消耗标准液的平均体积为:$\frac{22.62+22.72+22.80}{3}$mL=22.713mL,
该盐酸的浓度为:c(HCl)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1mol/L×0.022713L}{0.02L}$≈0.11mol/L,
故答案为:0.11mol/L;
③碱式滴定管装满溶液后,用拇指和食指拿住玻璃球所在部位并使乳胶管向上弯曲,出口管斜向上,然后在玻璃球部位侧面迅速捏橡皮管,使溶液从管口喷出,所以丙正确,
故答案为:丙;
④A、滴定终点读数时俯视读数,导致消耗标准液的体积读数偏低,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定结果偏低,故A错误;
B、碱式滴定管尖嘴部分有气泡,滴定后消失,则消耗的标准液体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定结果偏高,故B正确;
C、锥形瓶水洗后未干燥,对标准液的物质的量不影响,滴定时对标准液的体积没有影响,则测定结果不变,故C错误;
D、锥形瓶水洗后用待测稀盐酸溶液润洗,则锥形瓶中盐酸的物质的量偏大,在滴定时消耗的标准液体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定结果偏高,故D正确;
E、酸式滴定管水洗后未用待测稀盐酸溶液润洗,会导致盐酸浓度偏低,滴定时消耗的NaOH体积偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,测定结果偏低,故E错误;
故答案为:BD.
点评 本题考查中和滴定操作,题目难度中等,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项.


科目:高中化学 来源: 题型:填空题
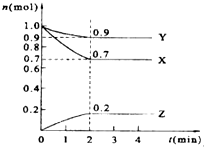 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
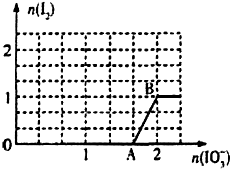 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com