
 2SO3(g) ”÷H£½£196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±¹²·Å³öČČĮæ176.4kJ£¬“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 molSO2ŗĶ1 molO2£¬“ļµ½ŠĀĘ½ŗā£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2SO3(g) ”÷H£½£196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±¹²·Å³öČČĮæ176.4kJ£¬“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 molSO2ŗĶ1 molO2£¬“ļµ½ŠĀĘ½ŗā£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ| A£®ČōŹ¹ÓĆøߊ§“߻ƼĮ£¬µŚŅ»“Ī“ļµ½Ę½ŗāŹ±·Å³öČČĮæ“óÓŚ176.4kJ |
| B£®µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷ÄŚŃ¹ĒæĪŖ0.7p |
| C£®“ļµ½ŠĀĘ½ŗāŹ±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżŌö“ó |
| D£®ČōÉżøßČŻĘ÷µÄĪĀ¶ČæÉŹ¹ŠĀĘ½ŗāŹ±ø÷ĪļÖŹµÄĢå»ż·ÖŹżÓėµŚŅ»“ĪĘ½ŗāŹ±ĻąĶ¬ |
 2SO3(g) ”÷H£½£196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±¹²·Å³öČČĮæ176.4kJ£¬“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 molSO2ŗĶ1 molO2£¬“ļµ½ŠĀĘ½ŗā£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ”£
2SO3(g) ”÷H£½£196 kJ”¤mol£1£¬Ī¬³ÖČŻĘ÷ĪĀ¶Č²»±ä£¬µŚŅ»“Ī·“Ó¦“ļµ½Ę½ŗāŹ±¹²·Å³öČČĮæ176.4kJ£¬“ĖŹ±ŌŁĻņČŻĘ÷ÖŠ³äČė2 molSO2ŗĶ1 molO2£¬“ļµ½ŠĀĘ½ŗā£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ”£


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĖįÓė¼īµÄÖŠŗĶ·“Ó¦ | B£®Ź³ĪļŅņŃõ»Æ¶ųøÆ°Ü |
| C£®ģŃÉÕŹÆ»ŅŹÆ”””” | D£®ÕØŅ©±¬ÕØ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĀĮʬÓėĻ”ŃĪĖį·“Ó¦ | B£®NH4ClÓėBa(OH)2”¤8H2OµÄ·“Ó¦ |
| C£®×ĘČȵÄĢ¼ŌŚ×ćĮæO2ÖŠČ¼ÉÕ | D£®Ėį¼īÖŠŗĶ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®µČĪļÖŹµÄĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ£¬Ē°Õ߷ųöČČĮæ¶ą |
| B£®ŅĄ¾ŻģŹÅŠ¾Ż¼“æÉÅŠ¶Ø£ØNH4£©2CO3ŹÜČČ·Ö½āæÉ×Ō·¢½ųŠŠ |
| C£®ČČ»Æѧ·½³ĢŹ½Ī“×¢Ć÷ĪĀ¶ČŗĶŃ¹Ē棬”÷H±ķŹ¾±ź×¼×“æöĻĀµÄŹż¾Ż |
| D£®ÄÜ×Ō·¢½ųŠŠµÄ·“Ó¦Ņ»¶ØŹĒ·ÅČČ·“Ó¦£¬²»ÄÜ×Ō·¢½ųŠŠµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®V3£¾V2£¾V4£¾V1 | B£®V3£¾V4£¾V2£¾V1 | C£®V3£¾V2£¾V1£¾V4 | D£®V2£¾V3£¾V1£¾V4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®H2O(g) = H2(g)+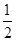 O2(g)”÷H£½ +242kJ·mol-1 O2(g)”÷H£½ +242kJ·mol-1 |
| B£®2H2(g)+O2(g)= 2H2O(l) ”÷H£½ £484kJ·mol-1 |
C£®H2(g)+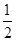 O2(g)=H2O(g) ”÷H£½ +242kJ·mol-1 O2(g)=H2O(g) ”÷H£½ +242kJ·mol-1 |
| D£®2H2(g)+O2(g)=2H2O(g) ”÷H£½ +484kJ·mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 pC(g)+qD(g)µÄĘ½ŗāĢåĻµ£¬µ±ÉżøßĪĀ¶ČŹ±ĢåĻµµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ¼õÉŁ”£ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £Ø £©
pC(g)+qD(g)µÄĘ½ŗāĢåĻµ£¬µ±ÉżøßĪĀ¶ČŹ±ĢåĻµµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ¼õÉŁ”£ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £Ø £©| A£®m+n >p+q,Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦ | B£®m+n >p+q,Õż·“Ó¦ŹĒĪüČČ·“Ó¦ |
| C£®m+n<p+q,Äę·“Ó¦ŹĒ·ÅČČ·“Ó¦ | D£®m+n <p+q,Äę·“Ó¦ŹĒĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®4Q1£«0.5Q2 | B£®4Q1£«Q2£«10Q3 | C£®4Q1£«2Q2 | D£®4Q1£«0.5Q2£«9Q3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā

| µĪ¶Ø“ĪŹż ŹµŃ鏿¾Ż£ØmL£© | 1 | 2 | 3 | 4 |
| V(ѳʷ) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)£ØĻūŗÄ£© | 15.95 | 15.00 | 15.05 | 14.95 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com