
����Ŀ������A��B��C��D���ֶ���������Ԫ�أ�����ԭ����������������֪B��Dͬ���塣AԪ�ص�������ۺ�����۵ľ���ֵ֮��Ϊ2��1molC����������ˮ��Ӧ���ڱ�״��������11.2LH2��D���ĵ��Ӳ�ṹ��Arԭ����ͬ����ش��������⣺
������ͼ��ʽ���ڱ���Ӧλ�ñ��A��B��C��D����Ԫ�ص�Ԫ�ط��š�ͬʱ��ͼ�н�����Ԫ��Ϳ�ڡ�
 _____________
_____________
���õ���ʽ��ʾB��C�γɻ�����Ĺ���___________��
��ͼ�С��ء���D�γɵļ����ӵİ뾶��СΪ________________�������ӷ��ź͡�>������=����<����ʾ����
��Ԫ�طǽ�����ǿ���Ƚ��кܶ��������A��D�ķǽ�����ǿ�����о������бȽϿ��е���_______������ţ���
�ٱȽ����ֵ��ʵ���ɫ�ڱȽ��⻯����ȶ���
�۱Ƚ�ԭ�Ӱ뾶��С�ܱȽ�����������Ӧˮ���������
��AԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1:3����Է�������Ϊ120.5��������ʵĽṹʽΪ____________��
���𰸡� 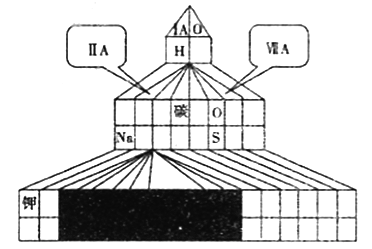
![]() r(Cl-)>r(K+) �ڢ�
r(Cl-)>r(K+) �ڢ� 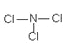
��������A��B��C��D���ֶ���������Ԫ�أ�����ԭ��������������D���ĵ��Ӳ�ṹ��Arԭ����ͬ����DΪClԪ�أ�B��Dͬ���壬��BΪFԪ�أ�1molC����������ˮ��Ӧ���ڱ�״��������11.2LH2�����������ʵ���Ϊ11.2L��22.4L/mol=0.5mol����C�ļ۵�����Ϊ0.5mol��2/1mol=1�����ڵڢ�A�壬ԭ����������FԪ�أ���CΪNaԪ�أ�AԪ�ص�������ۺ�����۵ľ���ֵ֮��Ϊ2��A����������Ϊ5��ԭ������С��Fԭ�ӣ���AΪNԪ�ء�
��1����ʽԪ�����ڱ���ʵ���ǽ�ԭ���ڱ��Ŀ�϶���ֽ�����ɾ���γɵģ���ԭԪ�����ڱ�û�б��ʵ������ڵ�������֮��Ģ�A�͢�A֮��Ϊ����Ԫ�أ���Ԫ�������ڱ���������ͼ�� ����2���õ���ʽ��ʾF��Na�γ�NaF���γɹ���Ϊ��
����2���õ���ʽ��ʾF��Na�γ�NaF���γɹ���Ϊ��![]() ����3��K+��Cl-�ĵ��Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������ӵİ뾶r��Cl-����r�� K+������4���ٵ��ʵ���ɫΪ�������ʣ�����˵���ǽ�����ǿ�������ڷǽ�����Խǿ���⻯��Խ�ȶ��ԣ����⻯���ȶ��Կ���˵������Ԫ�صķǽ�����ǿ������ȷ����ԭ�Ӱ뾶��С��ԭ�ӽṹ��Ӱ��Ԫ�طǽ����Ի����������أ���ԭ�Ӱ뾶��С����˵���ǽ���ǿ������������������Ӧˮ���������Խǿ������Ԫ�طǽ�����Խǿ����ȷ����Ϊ���ڢ�����5��NԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����ΪNR3�ͣ���Է�������Ϊ120.5��R�����ԭ������Ϊ(120.517)/3=35.5��ΪClԪ�أ��û�����ΪNCl3��������Nԭ����Clԭ��֮���γ�1�Թ��õ��Ӷԣ�������ʵĽṹʽΪ
����3��K+��Cl-�ĵ��Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�������ӵİ뾶r��Cl-����r�� K+������4���ٵ��ʵ���ɫΪ�������ʣ�����˵���ǽ�����ǿ�������ڷǽ�����Խǿ���⻯��Խ�ȶ��ԣ����⻯���ȶ��Կ���˵������Ԫ�صķǽ�����ǿ������ȷ����ԭ�Ӱ뾶��С��ԭ�ӽṹ��Ӱ��Ԫ�طǽ����Ի����������أ���ԭ�Ӱ뾶��С����˵���ǽ���ǿ������������������Ӧˮ���������Խǿ������Ԫ�طǽ�����Խǿ����ȷ����Ϊ���ڢ�����5��NԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����ΪNR3�ͣ���Է�������Ϊ120.5��R�����ԭ������Ϊ(120.517)/3=35.5��ΪClԪ�أ��û�����ΪNCl3��������Nԭ����Clԭ��֮���γ�1�Թ��õ��Ӷԣ�������ʵĽṹʽΪ![]() ��
��


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�����Ⱦ��ԭ����ȷ����
A. �ؽ�����ũҩ���ѷֽ��л���Ȼ����ˮ����Ⱦ
B. װ�β����еļ�ȩ����������뱵Ȼ���ɾ�����Ⱦ
C. SO2��NO2��CO2���ᵼ��������γ�
D. CO2�ͷ����������ʵĴ����ŷŻ��������ЧӦ�ļӾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺

��1�����Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��_________�������װ��ͼ����ĸ����ͬ������ȥ����ˮ�е�Cl-�����ʣ�ѡ��װ��_______��
��2���ӵ�ˮ�з����I2��ѡ��װ��_______���÷��뷽��������Ϊ___________��
��3��װ��A�Тٵ�������_________����ˮ�ķ����Ǵ�______�ڽ�ˮ��װ��B�ڷ�ҺʱΪʹҺ��˳���µΣ�Ӧ���еľ��������______________��
��4����ˮ���̲��ŷḻ����Դ����ʵ������ȡ������ˮ�������������̵�ʵ�飺
![]()
�����к�Ca2+��Mg2+��Fe3+��SO42�������ʣ���Ҫ�ᴿ������ۺ����á������ᴿ�IJ����У�
�����������Na2CO3��Һ���ڼ��������BaCl2��Һ�� �ۼ��������NaOH��Һ�� �ܵ�����Һ��pH����7�����ܽ⣻ ���ˣ� ����������ȷ�IJ���˳����__________����д��ţ���
a. �ݢڢۢ٢ޢܢ� b. �ݢ٢ڢۢޢܢ� c���ݢڢ٢ۢܢޢ� d. �ݢۢڢ٢ޢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Լռ����������71��������ʮ�־�Ŀ���DZ����
��1����ˮ���ܽ���̼ռ��ˮ��̼��95%���ϣ���Ҫ��HCO3����ʽ���ڣ���ȷ�������о�����̼ѭ���Ļ����������ܽ���̼���ɲ��õζ��ķ�����ȡ20mL��ˮ����ƿ�У���__________ʢװx molL��1HCl����Һ�ζ�������y mLHCl��Һ����ˮ���ܽ���̼��Ũ��=_______molL��1��

��2��������ɱ�ĺ�ѹ��P0���ܱ������У�һ������CO2��������̼��Ӧ��C(s)+CO2(g)2CO(g)��ƽ��ʱ����ϵ��CO2��CO��������������¶ȵĹ�ϵ��ͼ��ʾ��
����֪�������ѹ=������ѹ�������������������ش��������⣺
��C(s)+CO2(g)2CO(g) ��H____0�����������������������
��550��ʱ��������������壬ƽ��_____��������ƶ������������ƶ������ƶ�������
��650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ__________��
��925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=______________��
��3���ڹ�̬��������������У����¹����H2O��CO2��������Ʊ�H2��CO��һ����
����Դ���÷�ʽ������ԭ����ͼ��ʾ������X�ǵ�Դ��__________���������
�������������ķ�Ӧʽ�ǣ�____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϳ�·���еĻ�����I��һ����Ҫ�Ĺ�ҵԭ�ϣ���;�㷺��

��֪��
����A����Է�������Ϊ26��
�ڻ�����B���ɻ�����C�ķ�Ӧԭ��������100����
����E�dz��õ��л��ܼ���
�մ��������⣺
��1��A�Ļ�ѧ����Ϊ______________��E�����й�ƽ���ԭ����Ϊ__________����
��2��D�еĹ�����������________________��
��3����B����C�Ļ�ѧ����ʽΪ__________________________��
��4����E����F�ķ�Ӧ����Ϊ___________��D��H�ķ�Ӧ������Ϊ___________��
��5��ͬʱ��������������G��ͬ���칹�干��____�֣���д����һ�ֵĽṹ��ʽ_____
������NaHCO3��Һ��Ӧ��������
���ܷ���ˮ�ⷴӦ�����ܷ���������Ӧ
ClCH2COOH�Ǻϳɸʰ����ԭ��֮һ������B���ʾ�������Ӧ�Ʊ�ClCH2COOH���ϳ�·��Ϊ______________________�������Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������� (����)
A. 2 mol H2O��Ħ��������1 mol H2O��Ħ������
B. 200 mL 1 mol��L-1�Ȼ�����Һ��c(Cl-)��100 mL 2 mol��L-1�Ȼ�����Һ��c(Cl-)
C. 64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D. 20% NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10% NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��һ���������ϵ���Ҫ�ɷ�֮һ����ϳ�·�����£����ֲ���Ͳ��ַ�Ӧ������ȥ����

�Ѿ���![]() ��ش��������⣺
��ش��������⣺
��1����CH3��2C=CH2��ͬ���칹���д���˳���칹���л��������Ϊ__________��
��2��A�ĺ˴Ź������׳������ϵ�H�⣬����ʾ__________��壬�������Ϊ__________��
��3��D�����к��еĺ���������������__________��E�Ľṹ��ʽΪ__________��
��4�� �����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
�����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
D��G��Ӧ����H�Ļ�ѧ����ʽΪ______________________________��
��5��G��ͬ���칹���У�ͬʱ����������������__________�֣������������칹����
�ٱ��Ķ�ȡ���� ����FeCl3��Һ������ɫ��Ӧ �ۺ���-COO-���ṹ
��6�����������ϳ�·�ߣ��Ա�ϩΪԭ�ϣ����Լ���ѡ��������Ʊ�2��3-�������ĺϳ�·��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����ӡ���Ϣ����������ҪӦ�����������Ʊ�̫���ܵ�ء����й��ھ�����˵����ȷ����(����)
A. ��һ�ְ뵼����� B. Ӳ��С
C. �����»�ѧ���ʻ��� D. �۵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ƶ�������ȷ����
A�����ڿ�����ȼ������������
B����Ԫ������Ȼ���п���������̬��ʽ����
C�����������ƿ��Ա�����ú����
D��������Ͷ������ͭ��Һ����ͭ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com