
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
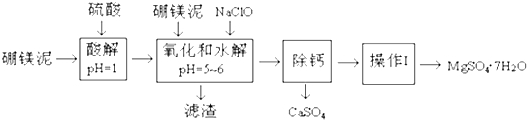
分析 硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)从影响反应速率的因素分析;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应;
(3)二氧化硅不与稀硫酸反应,所以在滤渣中存在;
(4)根据表中温度对硫酸镁、硫酸钙的影响完成;根据分离晶体与溶液方法分析;
(5)根据硼镁泥中MgO的质量分数(占35%),结合Mg原子守恒计算出生成MgSO4•7H2O质量及产率.
解答 解:硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)升高温度,增大接触面积,搅拌、增大反应物的浓度都可加快反应速率,故答案为:升温;把硼镁泥粉碎、搅拌等;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,并发生水解,反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,
故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+;
(3)SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液PH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤得滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,故答案为:SiO2;
(4)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤洗涤干燥,便得到MgSO4•7H2O,
故答案为:趁热过滤;过滤洗涤干燥;
(5)100g硼镁泥中氧化镁的物质的量为$\frac{100g×35%}{40g/mol}$=0.875mol,根据镁原子守恒,生成MgSO4•7H2O的物质的量为0.875mol,质量为246g/mol×0.875mol=215.25g,MgSO4•7H2O的产率为$\frac{172.2g}{215.25g}$×100%=80.0%,
故答案为:80.0%.
点评 本题考查从硼镁泥中提取MgSO4•7H2O的方法,为高频考点,侧重考查学生分析、应用及计算能力的综合考查,题目涉及反应速率、氧化还原反应及产率计算等,注意元素化合物知识、化学实验及反应原理的综合应用,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 118号是零族元素 | B. | 第七周期共有32种元素 | ||
| C. | 四种元素都有放射性 | D. | 四种元素都是金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| B. | 与氧气的燃烧反应:2CH3CH2OH+O2$\stackrel{点燃}{→}$2CH3CHO+2H2O | |
| C. | 与氧气的催化氧化:CH3CH2OH+3O2$→_{△}^{Cu或Ag}$2CO2+3H2O | |
| D. | 与乙酸的酯化反应:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3CH2OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于10s | B. | 等于5 s | C. | 大于10 s | D. | 小于10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1) | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去氯气中的HCl气体 | |
| B. | 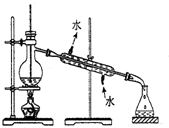 分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. | 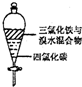 可以萃取,充分振荡后静置,下层溶液为橙红色,上层为无色 | |
| D. | 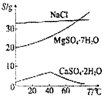 溶解度变化可知,在较低温度下容易分离MgSO4•7H2O和CaSO4•2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先滴加氯水,再滴加KSCN溶液后显红色 | |
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 | |
| C. | 滴加NaOH溶液,产生灰绿色沉淀,最后呈红褐色 | |
| D. | 只需滴加KSCN溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com