
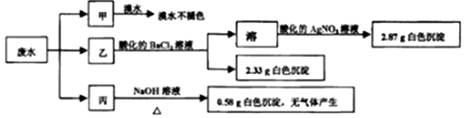
| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |
分析 分成3份,甲加入溴水,溴水不褪色,说明不含 SO32-;乙加入酸化的氯化钡,生成2.33g沉淀,一定含有SO42-,且n(SO42-)═n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,则至少加入0.01molBaCl2,溶液中加入硝酸银溶液生成沉淀为AgCl,n(AgCl)=$\frac{2.87g}{143.5g/mol}$=0.02mol=2n(BaCl2),说明原溶液不含Cl-;丙加入氢氧化钠溶液,生成0.58g白色沉淀,说明含有Mg2+,不含Fe3+,且n(Mg2+)=$\frac{0.58g}{58g/mol}$=0.01mol,无气体生成,说明不含NH4+,结合电荷守恒确定是否存在Na+、K+,以此解答该题.
解答 解:分成3份,甲加入溴水,溴水不褪色,说明不含 SO32-;乙加入酸化的氯化钡,生成2.33g沉淀,一定含有SO42-,且n(SO42-)=n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,则至少加入0.01molBaCl2,溶液中加入硝酸银溶液生成沉淀为AgCl,n(AgCl)=$\frac{2.87g}{143.5g/mol}$=0.02mol=2n(BaCl2),说明原溶液不含Cl-;丙加入氢氧化钠溶液,生成0.58g白色沉淀,说明含有Mg2+,不含Fe3+,且n(Mg2+)=$\frac{0.58g}{58g/mol}$=0.01mol,无气体生成,说明不含NH4+,
则可确定n(SO42-)=0.01mol,n(Mg2+)=0.01mol,不含SO32-、Cl-、NH4+、Fe3+,由电荷守恒可知电荷的物质的量为2n(Mg2+)=2n(SO42-)=0.02mol,溶液呈电中性,则不含Na+、K+,无须再用焰色反应检验,只有D正确.
故选D.
点评 本题考查无机物的推断,侧重常见阴阳离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH只与NH4HSO4反应 | |
| B. | (NH4)2SO4在水中的电离方程式:(NH4)2SO4=NH4++SO42- | |
| C. | NH4HSO4的物质的量是0.04 mol | |
| D. | (NH4)2SO4和NH4HSO4物质的量之比是1.87:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Cl-、NO3- | B. | K+、Fe3+、Cl-、SCN- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Al3+、K+、HS-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.2 mol•L-1•min-1 | B. | V(H2)=0.1 mol•L-1•min-1 | ||
| C. | V(NH3)=0.15 mol•L-1•min-1 | D. | V(H2)=0.4 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列说法正确的是( )
H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列说法正确的是( )| A. | 过程 1 放热 | B. | 过程 2 吸热 | C. | 过程 3 放热 | D. | 过程 4 放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
研究表明,在CuZnO2催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| B | Cl2的水溶液可以导电 | Cl2是电解质 |
| C | 将CO2气体通入苯酚钠溶液出现浑浊 | 酸性:H2CO3>苯酚 |
| D | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验步骤 | 现象 | 结论 | |
| A | 取待测液,滴加酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 待测液中可能含Fe2+ |
| B | 将待测气体通入品红溶液中,稍后加热溶液 | 开始品红溶液褪色,加热后又变为红色 | 待测气体中肯定含SO2 |
| C | 取待测液,滴加硝酸酸化的 BaCl2溶液 | 生成白色沉淀 | 待测液中可能含Ag+ |
| D | 将湿润的KI淀粉试纸较长时间置于待测气体中 | 取出后没有观察到试纸变色 | 待测气体中肯定不含Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com