
| A. | 胶体就是直径为10-9m~10-7m的微粒 | |
| B. | 实验室制备Fe(OH)3胶体的方法是将饱和FeCl3溶液滴入NaOH溶液并加热 | |
| C. | 电解Fe(OH)3胶体,阴极附近红褐色加深,是因为胶体带正电,向阴极移动 | |
| D. | 可以用丁达尔效应来区别胶体和溶液 |
分析 A.根据分散质粒子直径大小分类,把分散系分为:溶液、胶体、浊液.“纳米”是一个长度的单位,1 nm=10-9 m,溶液、浊液、胶体的本质区别就是分散质的微粒直径不同;
B.NaOH浓溶液滴加到热饱和FeCl3溶液中,发生复分解反应生成沉淀,氢氧化铁胶体的制备应是向沸水中逐滴加入饱和氯化铁溶液;
C.胶体不带电荷;
D.丁达尔效应是胶体特有的性质.
解答 解:A.溶液、浊液、胶体的本质区别就是分散质的微粒直径不同;分散系中分散质的微粒直径<1nm为溶液,微粒直径>100nm为浊液,分散质的微粒直径在1nm--100nm的分散系为胶体,所以胶体分散系中分散质的微粒直径为1nm--100nm,故A错误;
B.NaOH浓溶液滴加到热饱和FeCl3溶液中,发生复分解反应生成沉淀,氢氧化铁胶体的制备应是向沸水中逐滴加入饱和氯化铁溶液,继续煮沸,至溶液变为红褐色即停止加热,制备得到氢氧化铁胶体,故B错误;
C.胶体本身不带电荷,但胶体具有吸附性,吸附离子致使胶体微粒带有电荷,故C错误;
D.丁达尔效应是胶体特有的性质,而溶液不是胶体,故不能产生丁达尔效应,故D正确;
故选D.
点评 本题考查了胶体的制备和胶体的性质,题目难度不大,注意胶体制备方法和胶体的特征性质,掌握基础是解题关键.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 20 g氖气所含原子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高 | |
| B. | 烷烃都能使溴水、酸性KMnO4溶液褪色 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应 | |
| D. | 烷烃同系物的密度随着相对分子质量的增大逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的燃烧产物对大气无污染,因此它是一种优良的燃料 | |
| B. | 乙醇能与钠反应放出氢气,所以它是电解质 | |
| C. | 0.9%的乙醇可用于杀菌、消毒 | |
| D. | 甲醇和乙醇有相似的气味,均可用于配制饮用酒和调味用的料酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(S2-) | B. | c(Fe2+) | C. | c(H+) | D. | c(Fe2+)•c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
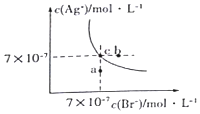 在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 图中a点对应的是AgBr的不饱和溶液 | |
| B. | 在t°C时,AgBr的Ksp为 4.9×10-13 | |
| C. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| D. | 在t°C时,AgCl(s)+Br-(aq)?AgBr(s)+C1-(aq)的平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③⑤ | C. | ③④⑥ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com