
| A、将水加热到120℃,pH=6:c(OH-)<c(H+) |
| B、醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)>c(Na+) |
| C、0.lmoI?L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室常用饱和NaHCO3溶液除去CO2中混有的SO2气体 |
| B、打开雪碧的瓶盖,立即有气体逸出 |
| C、经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全 |
| D、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
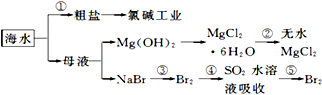 海洋 中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)下列说法不正确的是( )
海洋 中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)下列说法不正确的是( )| A、在过程③⑤中溴元素均被氧化 |
| B、从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程 |
| C、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| D、过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验Ⅰ:静置一段时间,小试管内有晶体析出 |
| B、实验Ⅱ:制取O2 |
| C、实验Ⅲ:除CO2气体中的HCl |
| D、实验Ⅳ:配制一定物质的量浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y一定位于周期表中同一周期 |
| B、X一定是金属元素Y一定是非金属元素 |
| C、X的最高价一定比Y的最高价低 |
| D、X的原子半径一定比Y的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com