
| A. | 第三电子层上有4个电子 | B. | 最高正价为+2 | ||
| C. | 最高正价为+4 | D. | 第二电子层没有未成对电子 |
分析 某元素的3p能级上有两个未成对电子,该元素原子最外层电子排布式为3s23p2或3s23p4,即该元素为Si元素或S元素,据此解答.
解答 解:某元素的3p能级上有两个未成对电子,该元素原子最外层电子排布式为3s23p2或3s23p4,即该元素为Si元素或S元素.
A.该元素第三电子层上电子数为2或4,故A错误;
B.该元素为Si元素或S元素,最高正价为+4或+6,故B错误;
C.该元素为Si元素或S元素,最高正价为+4或+6,故C错误;
D.第二电子层全部排满,没有未成对电子,故D正确,
故选D.
点评 本题考查结构位置性质关系,难度不大,推断元素是解题的关键,注意理解掌握核外电子排布规律.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 已知:部分物质沉淀的pH如表:
已知:部分物质沉淀的pH如表:| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可溶性盐的水溶液一定呈中性 | |
| B. | 离子化合物中一定含有金属元素 | |
| C. | 氧化还原反应中一定有元素化合价的升降 | |
| D. | 强电解质溶液的导电性一定强于弱电解质溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 | B. | 乙酸和硬脂酸 | ||
| C. | 苯甲酸和  | D. | 硝基乙烷(CH3CH2NO2)和氨基乙酸5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
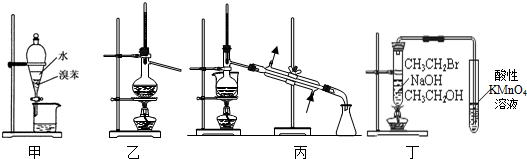
| A. | 甲装置:用所示装置分离出溴苯 | |
| B. | 乙装置:加热浓硫酸和乙醇混合液,制取乙烯 | |
| C. | 丙装置:加热苯和硝基苯的混合物,分离出苯 | |
| D. | 丁装置:验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
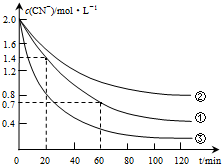 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
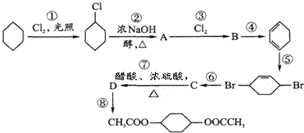 从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去):
从环己烷可制备1,4-环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去):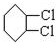 ,C
,C ,D
,D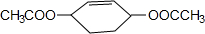 .
.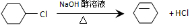 ;
;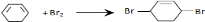 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com