
| A、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、常温常压下,14g氮气中含有 NA个原子 |
| C、标准状况下,22.4L水中含有的原子数为3NA |
| D、在25℃、101 kPa时,22.4 L氢气中含有NA个氢分子 |
| 14g |
| 14g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 |
| B、Cu为正极,Zn为负极,稀H2SO4作电解质溶液 |
| C、Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 |
| D、Fe为正极,Zn为负极,CuCl2溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列关于1S电子在原子核外出现的概率分布图,也称电子云示意图(如图所示)的有关说法中,正确的是( )
下列关于1S电子在原子核外出现的概率分布图,也称电子云示意图(如图所示)的有关说法中,正确的是( )| A、通常用小黑点来表示电子的多少, |
| B、小黑点密度大,说明在该核外空间电子数目多 |
| C、通常用小黑点来表示电子绕核作高速圆周运动 |
| D、小黑点密,表示在该核外空间的单位体积内电子出现的机会大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O |
| B、向氯化铜溶液中加入氢氧化钠溶液:Cu2++OH-=Cu(OH)2↓ |
| C、氯化铁溶液与铜反应:Fe3++Cu=Cu2++Fe2+ |
| D、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁矿石的主要成分与铁锈的主要成分相同 |
| C、磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变血红色 |
| D、FeO俗称铁红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
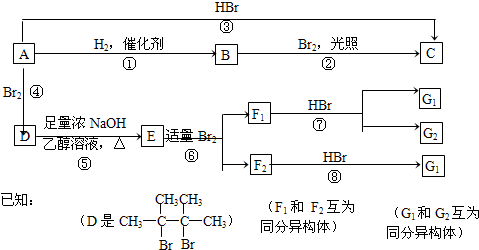
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com