
化学反应N2+3H2===2NH3的能量变化如图所示(假设该反应反应完全)
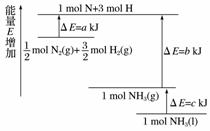
试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式。
科目:高中化学 来源: 题型:
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
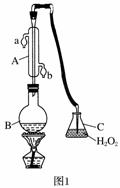

(1)仪器A的名称是______________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
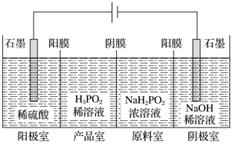
①写出阳极的电极反应式______________________________________________。
②分析产品室可得到H3PO2的原因__________________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有____________杂质。该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:
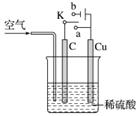
(1)甲同学认为在通入空气的同时,将开关K与______(填“a”或“b”)连接,即可实现。则此时石墨电极的反应式为__________________,电池的总反应式为________________________。电池工作时,H+向________(填“C”或“Cu”)极移动。
(2)乙同学认为,不通入空气,将K与______(填“a”或“b”)连接,也可以实现。则Cu极的电极反应式为________________________,总反应的离子方程式为________________________。若标准状况下产生2.24 L气体,则电路中转移的电子为______mol。
(3)丙同学认为还可以用如图所示装置模拟工业上电镀铜。他认为只要将C换成Fe(Cu足量),并将乙同学的实验持续足够长时间,即可实现在Fe上镀Cu。你认为他的想法______(填“正确”或“不正确”),理由是______________。这种方法得到的铜镀层______(填“牢固”或“不牢固”),理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
判断下列变化过程是否正确,正确的划“√”,错误的划“×”
(1)3AlCl(g)+3CO(g)===Al2O3(s)+AlCl3(g)+3C(s)
ΔH=a kJ·mol-1( )
(2)AlCl(g)+CO(g)===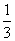 Al2O3(s)+
Al2O3(s)+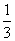 AlCl3(g)+3C(s)
AlCl3(g)+3C(s)
ΔH=-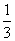 a kJ·mol-1( )
a kJ·mol-1( )
(3)2Al2O3(s)+2AlCl3(g)+6C(s)===6AlCl(g)+6CO(g)
ΔH=-2a kJ·mol-1( )
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_____________________________________________
________________________________________________________________________。
(2)已知:
甲醇脱水反应2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应2CH3OH(g)===C2H4(g)+2H2O(g)
ΔH2=-29.1 kJ·mol-1
乙醇异构化反应C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=______________ kJ·mol-1。
与间接水合法相比,气相直接水合法的优点是_____________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
374 ℃、22.1 MPa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水 ( )
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com