
| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 蛋白质、淀粉和油脂都属于高分子化合物,一定条件下都能水解 | |
| C. | 福尔马林、葡萄糖溶液与新制氢氧化铜悬浊液共热,都会有砖红色沉淀产生 | |
| D. | 构成物质微粒的种类和数量不同、彼此的结合方式多样,决定了物质的多样性 |
分析 A、天然水呈弱碱性的原因是水中存在弱酸的阴离子,阴离子水解结合水电离出的氢离子;
B、油脂的相对分子质量在10000以下;
C、福尔马林溶液是甲醛溶液,葡萄糖分子结构中含有醛基,都会和新制氢氧化铜反应生成砖红色沉淀;
D、物质的组成和机构决定了物质的性质.
解答 解:A、天然水呈弱碱性,是因为天然水中有CO32-或HCO3-它们水解使水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,故A错误;
B、油脂的相对分子质量在10000以下,则不属于高分子化合物,淀粉、蛋白质都属于高分子化合物,几种物质一定条件下都能水解,故B错误;
C、福尔马林溶液是甲醛溶液,葡萄糖分子结构中含有醛基,都会和新制氢氧化铜反应生成砖红色沉淀,是醛基的检验方法,故C正确;
D、构成物质的微粒的种类和数量的不同,决定了物质的结构的不同,而物质的结构决定物质的性质,从而决定了物质的多样性,故D正确.
故选CD.
点评 本题主要考查的是盐类水解的应用、生活中的化学知识,属于常考题,应注意化学知识在生活中的应用.


科目:高中化学 来源: 题型:选择题
| A. | 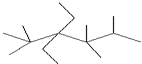 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 | |
| B. | 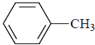 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 | |
| C. | 等物质的量的乙烯和乙醇的耗氧量相同 | |
| D. | 石油的分馏和煤的干馏都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 原子的M电子层上有3个电子 |
| C | 在短周期元素中,其原子半径最大 |
| D | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成D的单质和H2O |
| E | 元素最高价正价与最低负价的代数和为6 |
| A. | A的气态氢化物具有还原性,常温下,该氢化物水溶液的PH>7 | |
| B. | C单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 有B和E所形成的化合物中存在离子键,属于离子晶体 | |
| D. | C与D可形成不同原子个数比的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖及其水解产物均能发生银镜反应 | |
| B. | 用酸性KMnO4溶液即可鉴别2-丁烯和正丁醛 | |
| C. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| D. | 用甘氨酸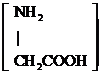 和丙氨酸 和丙氨酸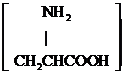 缩合最多可形成3种二肽 缩合最多可形成3种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=40ml时,溶液中存在c(OH-)=c(HT-)+2 c(H2T)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
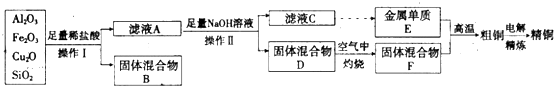
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 试 剂 | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | KNO3(NaCl) | AgNO3溶液 |
| C | Cl2(HCl) | 饱和食盐水 |
| D | CO2(HCl) | 饱和Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com