
【化学——选修3:物质结构与性质】(15分)
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为 ,其中心原子采取 杂化;化合物N在固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)Z原子基态时的外围电子排布式为 ;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为 。

(5)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为 。
(15分)(1)平面三角形 (2分) sp2 (2分) 分子晶体(2分)
(2)C<O<N(2分)
(3)N2O (2分 ) (4)3d24s2 (2分) 6(1分)
(5)2CNO-+2H++3ClO-=N2+2CO2+3Cl-+H2O(2分)
【解析】
试题分析:由题意可知Q是H元素,原子半径最小;R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;则R的电子排布是1s22s22p2,所以R是C元素;Y的基态原子的核外成对电子数是未成对电子数的3倍,则Y是O元素,成对电子数是6个,未成对电子数是2个;则X只能是N元素;Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M是HCHO;Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78,则相对分子质量是78的烃是C6H6,所以N是苯;Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,Ar的原子核内有18个质子,则Z的原子核内有18+4=22个质子,所以Z是Ti元素。
(1)HCHO分子中,C原子的价层电子对数是3,是sp2杂化,空间构型是平面三角形;苯属于分子晶体;
(2)C、N、O原子中,N原子的2p轨道为半充满的稳定状态,所以第一电离能大于O,随核电荷数的增大,同周期元素的第一电离能逐渐增大,所以三者的第一电离能的由小到大的顺序是C<O<N;
(3)CO2分子中有3个原子、16个价电子,所以与二氧化碳是等电子体的分子是N2O;
(4)Ti是第四副族元素,基态原子中外围电子排布式为3d24s2;根据晶胞的结构图可知,晶体内与每个Z原子等距离且最近的氧原子数为6,以顶点的Ti原子为中心,同层有4个,上下各一个;
(5)由R、X、Y三种元素组成的CNO-离子在酸性条件下可与NaClO溶液反应,生成N2、CO2等物质,根据元素守恒,则产物中有水、氯离子生成,反应的离子方程式是)2CNO-+2H++3ClO-=N2+2CO2+3Cl-+H2O。
考点:考查元素的推断,物质的结构与性质的应用,晶胞的计算,离子方程式的书写


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:填空题
(本题共12分)
某酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):

49.A→B的反应类型是________,B→C为加成反应,则化合物M的结构简式是____________;
50.H中除了羰基( )外,含有的官能团名称是_______________;
)外,含有的官能团名称是_______________;
51.E→ F的化学方程式是__________________________________;
52.TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱表明,分子中除苯环外,其它氢原子化学环境相同;②存在甲氧基(CH3O—)。TMOB的结构简式是_______________;
53.下列说法正确的是
A.D和F中均属于炔烃类物质
B.A能和HCl反应得到聚氯乙烯的单体
C.1mol G完全燃烧生成7mol H2O
D.H能发生加成、取代反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
下列有关金属腐蚀的推断正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程
B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH-
C.1.68g铁粉发生吸氧腐蚀时,理论上最多能吸收氧气504mL(标准状况)
D.镀锌铁皮的镀层损坏后,铁更容易腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
某化合物结构简式为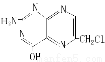 ,下列关于其说法正确的是
,下列关于其说法正确的是
A.分子中碳原子与氮原子的个数比是7∶5
B.属于芳香族化合物
C.能与氢氧化钠溶液反应,但不能与盐酸反应
D.属于苯酚的同系物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:选择题
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:

下列说法正确的是
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 A13+和C1―
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:填空题
(8分)已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。

(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1________α2(填“大于”、“小于”、“等于”或“无法确定”),若二者恰好反应所得溶液的pH<7,原因是__________________。(用离子方程式表示)
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
已知A、B为单质,C为化合物。且有如下转化关系

①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液与Na2CO3溶液反应,放出CO2气体,则A可能是H2
③若C溶液中滴加NaOH溶液,先生成沉淀后又溶解,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:填空题
(3分)下列有关实验的叙述中,合理的是
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com