
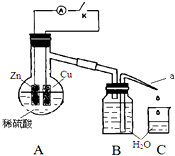
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析 (1)Zn与稀硫酸反应生成硫酸锌和氢气;
(2)浓硫酸具有强氧化性,与锌反应生成二氧化硫、硫酸锌、水;
(3)①Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
②ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2↑,据此计算;
(4)①形成原电池能加快反应速率;
②根据氢离子浓度大小与速率的关系分析;
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,根据温度对速率的影响分析.
解答 解:(1)Zn与稀硫酸反应生成硫酸锌和氢气,其反应的离子方程式为:Zn+2H+=Zn2++H2↑;
故答案为:Zn+2H+=Zn2++H2↑;
(2)浓硫酸具有强氧化性,与锌反应生成二氧化硫、硫酸锌、水,不能生成氢气,稀硫酸才能与锌反应生成氢气;
故答案为:浓H2SO4具有强氧化性,不能生成氢气;
(3)①Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
②ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2↑,则△H=(-332kJ/mol)+(-112kJ/mol)-(-286kJ/mol)=-158kJ/mol;
故答案为:-158;
(4)①形成原电池能加快反应速率,所以在反应初期,闭合K时比断开K时的反应速率快,
故答案为:快;形成原电池反应速度快;
②由于反应前期形成原电池反应速率快,氢离子消耗的多,则在后期,闭合K时溶液中氢离子浓度小,氢离子浓度越小反应速率越小,断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),所以在反应后期,断开K时的反应速率快于闭合K时的反应速率;
故答案为:断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+);
③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,则随着反应进行,断开K时,放出的热量使溶液的温度升高,温度越高反应速率越快;
故答案为:断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
点评 本题考查了盖斯定律的应用、原电池原理的应用、影响速率的因素等,题目难度中等,注意形成原电池能加快反应速率,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
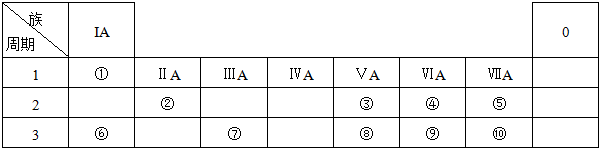
| 族 周期 | IA | 0 | ||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应③的离子方程式为5Br-+BrO3-+6H+═3Br2+3H2O | |
| B. | ②③的目的是富集溴,提高Br2的浓度 | |
| C. | 蒸馏塔温度控制在90℃左右的原因是防止温度过高将水蒸馏出来 | |
| D. | 从海水中提取任何化学物质都需要经过化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com