
����Ŀ��(1)Fe(CO)5�����Ļ��ϼ�Ϊ0��д����ԭ�ӵļĻ�̬�����Ų�ʽ______��Fe�����ڱ��е�______����______�壬����_______����
(2)��֪Fe(CO)5�����³�Һ̬���۵�Ϊ��20.5 �棬�е�Ϊ103 �棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)5����Ϊ________��������ͣ���
(3)���������ʵľ����ڲ�ͬ�¶��������ֶѻ���ʽ�������ֱ�����ͼ��ʾ��

����������������������������ʵ�ʺ��е���ԭ�Ӹ���֮��Ϊ________��Feԭ����λ��֮��Ϊ____�������־��������ڽ�����ԭ�Ӽ������ͬ�������������������������������ܶ�֮��Ϊ_______��
(4)��֪��Yԭ������������Ӧˮ�����������ǿ��ͭ��Y�γɻ�����ľ�����ͼ��ʾ(�ڵ����ͭԭ�ӣ�����Բ����Yԭ��)��
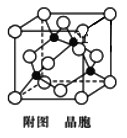
�ٸþ���Ļ�ѧʽΪ________������Ԫ�ط��ű�ʾ��
����֪�þ�����ܶ�Ϊ�� g/cm3�������ӵ�����ΪNA����þ����߳�Ϊ______nm(ֻд����ʽ)��
���𰸡�[Ar]3d64s2 �� �� d ���� 1��2 2��3 ![]() ��8 CuCl
��8 CuCl ![]() ��107
��107
��������
(1)Fe��ԭ������Ϊ26�����õ����Ų���������д�����Ų�ʽ��
(2) Fe(CO)5�����³�Һ̬���۷е�ϵͣ�ӦΪ���Ӿ��壻
(3)���ݾ�̯�����㾧����FeԪ����Ŀ���㣻
(4)��Yԭ������������Ӧˮ�����������ǿ����YΪCl����̯�����㾧����Cu��Clԭ����Ŀȷ����ѧʽ��
�ں�ɫ��������Χ��4����ɫ���γ���������ṹ����ɫ��λ��������������ģ���ɫ���뾧�������ɫ�����ߴ��ھ�����Խ����ϣ��Ҷ���֮�����Ϊ��Խ��߳��ȵ�![]() ����������Խ��߳���Ϊ�����ⳤ��
����������Խ��߳���Ϊ�����ⳤ��![]() ������Ͼ�����Cu��Clԭ����Ŀ��ʾ������������������������Ҳ���ھ�������뾧���ܶȳ˻����������㡣
������Ͼ�����Cu��Clԭ����Ŀ��ʾ������������������������Ҳ���ھ�������뾧���ܶȳ˻����������㡣
(1)Fe��ԭ������Ϊ26�����̬�����Ų�ʽΪ[Ar]3d64s2��Feԭ�Ӻ���������Ӳ���еĵ�����Ϊ2��8��14��2���ɼ������ڱ��е������ڵ�VIII�壬����d����
(2)Fe(CO)5�����³�Һ̬���۷е�ϵͣ������ڷǼ����ܼ���ӦΪ���Ӿ��壻
(3)�������������к��е�Feԭ����Ϊ![]() =2���������������к��е���ԭ�Ӹ���
=2���������������к��е���ԭ�Ӹ���![]() =4�����Զ��ߺ��е�Feԭ�Ӹ���֮��Ϊ2��4=1��2��
=4�����Զ��ߺ��е�Feԭ�Ӹ���֮��Ϊ2��4=1��2��
��������������Feԭ����λ����8������������������Feԭ����λ����![]() =12�����Զ���Feԭ�ӵ���λ���ı���8��12=2��3��
=12�����Զ���Feԭ�ӵ���λ���ı���8��12=2��3��
�����־��������ڽ�����ԭ�Ӽ������ͬ������Feԭ�Ӱ뾶ΪR������������������ΪR1������ԭ�ӵ����λ�ÿɵ�![]() R1=4R��R1=
R1=4R��R1=![]() �������������������к���2��Feԭ�ӣ������������������ܶ�Ϊ
�������������������к���2��Feԭ�ӣ������������������ܶ�Ϊ![]() =
=![]() ����������������������ΪR2������ԭ�ӵ����λ�ÿɵ�
����������������������ΪR2������ԭ�ӵ����λ�ÿɵ�![]() R2=4R��R2=
R2=4R��R2=![]() �������������������к���4��Feԭ�ӣ��������ܶ�
�������������������к���4��Feԭ�ӣ��������ܶ�![]() =
=![]() ����
����![]()
![]() ��8��
��8��
(4)��Yԭ������������Ӧˮ�����������ǿ����YΪCl��������Cuԭ����Ŀ=4��Clԭ����Ŀ=8��![]() =4��Cu��Clԭ����Ŀ֮��Ϊ1��1�����Ըþ���Ļ�ѧʽΪCuCl��
=4��Cu��Clԭ����Ŀ֮��Ϊ1��1�����Ըþ���Ļ�ѧʽΪCuCl��
�ھ����ⳤΪLpm������һ�������к���4��CuCl�����ݾ����ܶȹ�ʽ![]() ����L3=V�ɵþ�������L=
����L3=V�ɵþ�������L=![]() =
=![]() ��1017nm��
��1017nm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��B���ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A(g)+B(g) 2C(g)+2D(g)����Ӧ���е�10sĩ�����A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol����
(1)��C��ʾ10s�ڷ�Ӧ��ƽ����Ӧ����Ϊ__��
(2)10sĩ��������D��Ũ��Ϊ__��
(3)���ı���������������D��������α仯(��������������С���������������)��
��� | �ı������ | ����D������ |
�� | �����¶� | ___ |
�� | ����A��Ũ�� | ___ |
�� | ʹ�������� | ___ |
�� | �����³���Ne (��������ϵ��Ӧ) | ___ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NA�ǰ����ӵ�������ֵ������˵���������
A. 3g 3He���е�������Ϊ1NA
B. 1 L 0.1 mol��L1��������Һ���е�![]() ��ĿΪ0.1NA
��ĿΪ0.1NA
C. 1 mol K2Cr2O7����ԭΪCr3+ת�Ƶĵ�����Ϊ6NA
D. 48 g�������10 g�춡��Ļ�����й��ۼ���ĿΪ13NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݼ۲���ӶԻ������ۣ�����ԭ���ӻ��������Ϊsp2����Ϊ��������
A. CH3ClB. SO32��C. NF3D. CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ϊ��ɫ���壬�����������ӹ��ɣ���֪�������ӹ���Ϊƽ�������Σ����������ӵĹ��ͺ��������е����ӻ���ʽΪ�� ��
A. ƽ�������� sp2�ӻ�B. V�� sp2�ӻ�
C. ������ sp3�ӻ�D. ֱ���� sp�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�����˵����ȷ����
A. ��ϵͳ������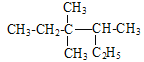 ������Ϊ3��3-����-2-�һ�����
������Ϊ3��3-����-2-�һ�����
B. ��һ�������£����ᡢ�������ᡢ�����ʾ�����NaOH������Ӧ
C. ����ʽΪC5H12O�Ĵ�����8 �֣������ܴ�������ȩ��ͬ���칹����3 ��
D. ����ϩ( PE)�;�����ϩ( PVC)�ĵ��嶼�Dz�����������Щ�������ʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ijԪ�ص��Ȼ���
ijԪ�ص��Ȼ���![]() ����ˮ�Ƴ���Һ����
����ˮ�Ƴ���Һ����![]() ��Һǡ����ȫ��Ӧ����֪��Ԫ��ԭ�Ӻ�����20�����ӣ���XԪ�ص�������___��������___����д��XԪ����Ԫ�����ڱ��е�λ��(��Ҫд���������)___��
��Һǡ����ȫ��Ӧ����֪��Ԫ��ԭ�Ӻ�����20�����ӣ���XԪ�ص�������___��������___����д��XԪ����Ԫ�����ڱ��е�λ��(��Ҫд���������)___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ŵ�������Ի���������Ӱ����������أ��������������Ⱦ���еĵ��������Ϊ���ǹ�ע����Ҫ����֮һ��
��.����NH3�Ļ�ԭ�Կ������������������Ⱦ�����г�ȥNO����Ҫ��Ӧ���£�4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ��H��0
5N2(g)+6H2O(l) ��H��0
(1)д��һ�ֿ������NO��ת���ʵķ�����__________
(2)һ���¶��£��ں����ܱ������а���n(NH3)�Un(NO) =2�U3���뷴Ӧ�����������Ӧ�����������жϸ÷�Ӧ�ﵽƽ��״̬����___________
A.c(NH3)�Uc(NO) =2�U3 B.n(NH3)�Un(N2) ���� C.������ѹǿ���� D.�����ڻ��������ܶȲ��� E.1molN��H�����ѵ�ͬʱ������1molO��H��
(3)��֪�÷�Ӧ����v��=k����c4(NH3)��c6 (NO)��v��=k����cx(N2)��cy(H2O) (k����k���ֱ��������淴Ӧ���ʳ���)���÷�Ӧ��ƽ�ⳣ��K=k��/k��,��x=_____��y=_______��
(4)ij�о�С�齫2molNH3��3molNO��һ������O2����2L�ܱ������У���Ag2O�������淢��������Ӧ��NO��ת�������¶ȱ仯�������ͼ��ʾ��

����5min�ڣ��¶ȴ�420K���ߵ�580K����ʱ����NO��ƽ����Ӧ����v(NO)=_______;
�������������£��¶�580K֮��NO����N2��ת���ʽ��͵�ԭ�������___________��
��.������[(NH2)2CO]ˮ��Һ���յ�������Ҳ��һ�ֿ��еķ�����NO��NO2��ͬ��Ȼ����ͨ��������Һ�У��ܵ���ԭ������ȹ�ϵ��ͼ��

(5)������[(NH2)2CO]ˮ��Һ���������Ϊ1��1��NO��NO2��������ɽ�NԪ��ת��Ϊ�Ի����������塣д���÷�Ӧ�Ļ�ѧ����ʽ____��
(6)����NO��NO2��ȵ���ߣ��ܵ���ԭ�ʽ��͵���Ҫԭ����________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com