
|
常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后恰好完全反应(不考虑混合后溶液体积的变化),则下列说法不正确的是 | |
| [ ] | |
A. |
反应后的溶液呈中性 |
B. |
醋酸和氢氧化钠溶液混合前溶质物质的量浓度相同 |
C. |
反应后溶液中:C(H+)·C(OH-)=10-14 |
D. |
反应后溶液中存在平衡:CH3COO-+H2O |
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:浙江省金华一中2011-2012学年高二下学期期中考试化学试题 题型:022
食醋分为酿造醋和配制醋两种.国家标准规定酿造食醋总酸含量不得低于3.5 g/100 mL.
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是________.
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75 mol·L-1,则该食醋的总酸量为4.5 g/100 mL.
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________(填写序号).
a.pH
b.电离度
c.电离常数
d.溶解度
(3)常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1HCl溶液和20.00 mL 0.1000 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示.
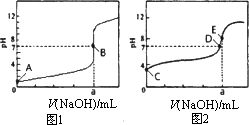
①滴定醋酸溶液的曲线是________(填“图1”或“图2”);滴定曲线中a=________mL;
②E点pH>8的原因用离子方程式表示________.
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是________.
a.电解,NaOH溶液
b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液
d.中和滴定,pH试纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com