
为了测定某铜银合金的成分,将30.0g合金溶于80ml13.5mol/L的浓硝酸中,待合金完全溶解后,收集到标况气体6.72L,并测得溶液的C(H+)=1moL/L,假设反应后溶液的体积仍为80mL,计算:
(1)被还原的硝酸的物质的量.
(2)合金中银的质量分数.
考点: 有关混合物反应的计算.
分析: (1)被还原的硝酸生成NO2或NO2、NO混合物,根据N元素守恒计算被还原硝酸的物质的量;
(2)令混合物中Cu、Ag物质的量分别为xmol、ymol,产物Cu(NO3)2、AgNO3中含NO3﹣物质的量各为2xmol、ymol,根据合金质量及N原子守恒列方程,再根据m=nM计算Ag的质量,进而计算合金中银的质量分数.
解答: 解:(1)被还原的硝酸生成NO2或NO2、NO混合物,根据N元素守恒,故被还原的n(HNO3)=n(气体)=6.72 L÷22.4L/mol=0.3mol,
答:被还原的硝酸的物质的量为0.3mol.
(2)反应的n(HNO3)=13.5 mol/L×0.08L﹣1 mol/L×0.08L=1 mol
设合金中铜、银物质的量分别为xmol、ymol,则:64x+108y=30
产物Cu(NO3)2、AgNO3中含NO3﹣物质的量各为2x mol、y mol,据N守恒可得:2x+y+0.3=1
联立方程,解得x=0.3 y=0.1 mol
故合金中银的质量=0.1 mol×108g/mol=10.8g,合金中Ag的质量分数为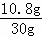 ×100%=36%,
×100%=36%,
答:合金中银的质量质量分数为36%.
点评: 本题考查混合物计算、氧化还原反应计算,难度中等,注意反应中硝酸起氧化剂、还原剂作用,注意利用守恒法解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某化学兴趣小组学习原电池知识后,决定用其原理,尝试利用铁粉、活性炭、无机盐等物质开发产品.小组提出的设想或对原理的理解不正确的是()
A. 打算制成小包装用于糕点的脱氧剂
B. 利用反应放出热量的原理制成暖宝宝
C. 调整电池结构,可降低温度,可用于延长糕点保质期
D. 正极的电极反应为:2H2O+O2+4e﹣=4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨电极电解100mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为()
A. 1mol•L﹣1 B. 2 mol•L﹣1 C. 3 mol•L﹣1 D. 4 mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
铜和镁的合金4.6g完全溶于浓硝酸,若反应后硝酸被还原只产生 2.24L的 NO2气体和1.12L的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为()
A. 9.02g B. 8.51g C. 8.00g D. 7.04g
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性溶液中能大量共存的离子组是( )
|
| A. | Ca2+、Na+、NO3﹣、CO32﹣ | B. | Mg2+、Cl﹣、NH4+、SO42﹣ |
|
| C. | K+、Cl﹣、HCO3﹣、NO3﹣ | D. | Ca2+、Na+、Fe2+、NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
纯碱、烧碱等是重要的化工原料.
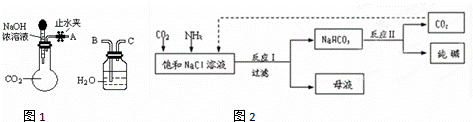
(1)利用如图1所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 .若其它操作不变,将A与C连接,可观察到的现象是 .
(2)向100mL 2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是 (写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | ||
| ②过滤,取2mL滤液于试管中 | ||
| ③ |
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图2:
已知NaHCO3在低温下溶解度较小.反应I为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
①向母液中加入石灰乳,可将其中 循环利用.
②向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体.试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
某化合物的结构(键线式)及球棍模型如下.该有机分子的核磁共振波谱图如下(单位是ppm):
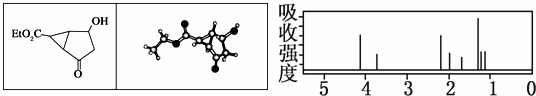
下列关于该有机物的叙述正确的是( )
|
| A. | 右图中最强吸收峰与最弱吸收峰高度比为3:2 |
|
| B. | 该有机物分子中含有4个手性碳原子 |
|
| C. | 键线式中的Et代表的基团为﹣CH3 |
|
| D. | 该有机物在一定条件下能够发生消去反应和取代反应,但不能发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com