
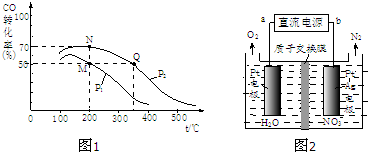
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||


科目:高中化学 来源:不详 题型:单选题
| A.2KClO3(s)=2KCl(s) +O2(g) ΔH=-78.03 kJ·mol-1ΔS=1110 J·mol-1·K-1 |
| B.CO(g)=C(s石墨) +1/2O2(g) ΔH=110.05 kJ·mol-1ΔS=-89.36 J·mol-1·K -1 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1ΔS=-280.3 J·mol-1·K-1 |
| D.NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COO NH4(aq)+H2O(l) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.△H=△H1+
| B.△H=△H1+
| ||||||||
| C.△H=△H1+2△H2+2△H3 | D.△H=2△H1+△H2+△H3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向蒸馏水中滴加浓H2SO4时,KW不变 |
| B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12 |
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3+ 2OH- H2CO3+ 2OH- |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:10 | B.1:1 | C.1:2 | D.1:20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.小烧杯内残留有水,会使测得的反应热数值偏小 |
| B.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.可用相同浓度和体积的硝酸代替稀盐酸溶液进行实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com