
| A. | NH4N03是离子化合物,KN03是共价化合物 | |
| B. | NH4N03是共价化合物,KN03是离子化合物 | |
| C. | NH4N03和KN03都是离子化合物 | |
| D. | NH4N03和KN03都是共价化合物 |
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a和b可形成气态化合物 | |
| B. | c的原子半径小于d的原子半径 | |
| C. | b和c形成的化合物为离子化合物 | |
| D. | a和d最高价氧化物的水化物均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 分子式是C20H12O4 | B. | 能与NaOH稀溶液反应,溶液显红色 | ||
| C. | 能与溴水反应,溶液显红色 | D. | 与羧酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
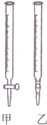 某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.00 | 22.99 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
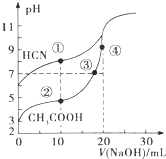
| A. | 点③溶液中,c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| C. | 点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com