
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
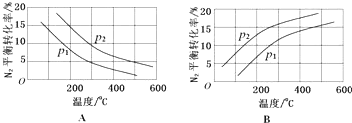
分析 (1)①温度越高,K越大,说明升高温度,平衡正移;
②K值很小,转化率很小;
③合成氨反应中,在500℃左右催化剂活性最高;
(2)合成氨反应为放热反应,升高温度,转化率减小;增大压强平衡正向移动,转化率增大;
(3)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),据此分析.
解答 解:(1)①由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,故答案为:吸热;
②由表格数据可知,2000℃时,K=0.1,K值很小,则转化率很小,不适合大规模生产,所以人类不适合大规模模拟大气固氮,
故答案为:K值小,正向进行的程度小(或转化率低),不适合大规模生产;
③合成氨反应中,反应温度越高,反应速率越快,但是该反应为放热反应,温度高转化率会降低,而且在500℃左右催化剂活性最高,所以从催化剂活性等综合因素考虑选择500℃左右合适;
故答案为:从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适;
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,р2的转化率大,则р2大;
故答案为:A;р2>р1;
(3)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案为:+1530 kJ•mol-1.
点评 本题考查了平衡常数的应用、合成氨反应的条件选择、影响化学平衡的因素、电解原理的应用、盖斯定律的应用等,题目难度中等,侧重于基础知识的综合应用考查,注意把握K与温度的关系以及影响化学平衡的因素.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | R为ⅤA族元素 | |
| B. | R的氢化物的水溶液属于强酸 | |
| C. | 氧化剂与还原剂的物质的量之比为5:1 | |
| D. | R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 比较金属性:Mg>Al | 往盛同浓度同体积的盐酸的两试管中分别加入Mg条和Al粉 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 比较氧化性:Fe3+>I- | 往滴有CCl4的FeI2溶液中慢慢滴加氯水 |
| D | 配制1.0mol/L的NaOH溶液 | 称取4g NaOH晶体溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
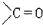 +RMgX→
+RMgX→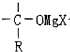 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$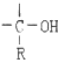
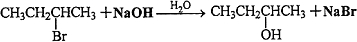 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | NaCl | C. | Na2CO3 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向一定量的Al2(SO4)3溶液中逐滴加入氨水至过量,反应的离子方程式是Al3++4OH-=AlO2-+2H2O | |
| B. | 向一定量的NaHCO3溶液中加入足量的澄清石灰水,产生白色沉淀,反应的离子方程式是 Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向适量某溶液中滴入KSCN溶液,溶液变为红色,则该溶液中一定存在Fe3+而不存在Fe2+ | |
| D. | 高锰酸钾酸化要用硫酸而不能用盐酸,其原因是用盐酸酸化会发生反应:10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:c>d | |
| B. | a、b、d的最高价氧化物对应的水化物两两皆能反应 | |
| C. | a、b、c的简单离子都会破坏水的电离平衡 | |
| D. | 简单离子的半径:c>d>a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com