
【题目】硫酸生产中炉气转化反应为2SO2(g)+O2(g)![]() 2SO3(g)。研究发现,SO3的体积分数 (SO3%)随温度(T)的变化如曲线I所示。下列判断不正确的是
2SO3(g)。研究发现,SO3的体积分数 (SO3%)随温度(T)的变化如曲线I所示。下列判断不正确的是
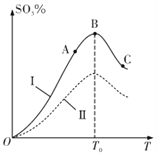
A. 该反应的正反应为放热反应
B. 曲线I上A、C两点反应速率的关系是:VA<VC
C. 反应达到B点时,2V正(O2) = V逆(SO3)
D. 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则Ⅱ可表示用Fe2O3作催化剂的曲线
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是 ( )
A. S2和S8的混合物共6.4g,其中所含硫原子数为0.2NA
B. 足量的铜片与含4molHNO3的浓硝酸充分反应生成的二氧化氮的分子数为2NA
C. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA
D. 30g甲醛中含有的共用电子对数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在恒容密闭容器中充入N〇2,发生反应2NO2(g)![]() N2O4(g) ΔH<0,达到平衡后,下列说法不正确的是
N2O4(g) ΔH<0,达到平衡后,下列说法不正确的是
A. 再充入少量NO2,达平衡后NO2的转化率增大
B. 再充入少量NO2,达平衡后NO2的体积分数增大
C. 再充入少量N2O4,平衡向逆反应方向移动,达到新平衡后NO2的体积分数减小
D. 升高温度,体系的颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图中的物质均为初中化学常见物质,其中A为大理石主要成分,F是黑色粉末,H是蓝色沉淀,如图是它们之间的转化关系,请回答: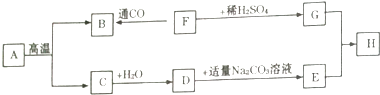
(1)写出下列物质的化学式:A , D , F .
(2)写出G+E→H的化学方程式: .
(3)写出物质B的一种用途: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质监测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
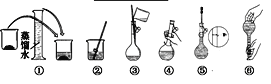

(1)该同学应选择____mL的容量瓶。
(2)其操作步骤如图所示,则上图框中操作应在图中__________ (填选项字母)之间。
A.②与③ B.①与② C.③与④
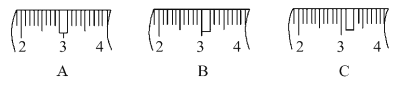
(3)该同学应称取NaOH固体____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(4)下列操作对所配溶液的浓度大小有何影响(填“偏大” “偏小”或“无影响”)。
①定容时,俯视读数,浓度会________;②转移溶液过程中,少量液体溅出来,浓度会____________;
③容量瓶未干燥,浓度会__________;
④定容摇匀后发现溶液凹面低于刻度线,浓度会______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
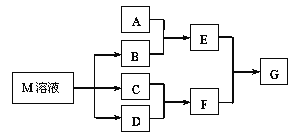
(1)写出用惰性电极电解M溶液的离子方程式____________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是__________________。
(3)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如下图所示,“则A与B溶液”反应后溶液中的溶质为__________(填化学式)。
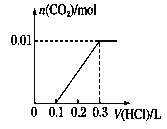
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所能观察到的实验现象是____________________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚后溶液显紫色,则由A转化成E的离子方程式是_______________ ;
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,请写出足量E与D反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按![]() ∶
∶![]() =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
=1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
① 该反应的平衡常数K随温度升高而__________(填“增大”或“减小”)。
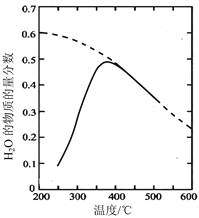
② 温度过高或过低均不利于该反应的进行,原因是________。
③ 200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
① 已知CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1、–242 kJmol-1,Bosch反应的ΔH =________kJmol-1。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热)
② 一定条件下Bosch反应必须在高温下才能启动,原因是________。
③ 新方案的优点是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是由_________________________(或__________________)熔合而成的具有____________的物质,与各成分的金属相比,其特点为硬度比纯金属________,熔点比各成分金属__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com